Sulfuric acid là hoá chất quan trọng số một trong công nghiệp hoá học. Sulfuric acid được dùng để xuất phân bón, chất tẩy rửa, sơn, phẩm nhuộm, chế tạo acquy,… Người ta sản xuất sulfuric acid trong 3 nghiệp theo sơ đồ:
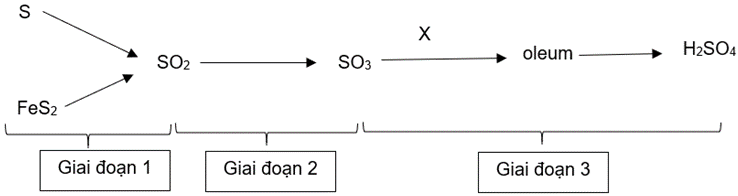
Câu 1.
a) Trong sơ đồ điều chế trên có 4 phản ứng oxi hoá – khử.
b) Giai đoạn 3 chất X là H2SO4 loãng.
c) Theo QCVN 05:2013/BTNMT về ô nhiễm chất lượng không khí hàm lượng cho phép tối đa của SO2 là 350 μg/m³ không khí đo trong một giờ. Nếu người ta lấy 50 lít không khí trong một giờ ở một thành phố và phân tích thấy có 0,018 mg SO2 thì không khí ở đó không bị ô nhiễm.
d) Sulfuric acid loãng dùng để tạo môi trường acid trong sản xuất acquy chì.
Câu 2.
a) Trong sơ đồ trên, tất cả các phản ứng xảy ra đều là phản ứng oxi hoá – khử.
b) Để tiết kiệm hoá chất, giai đoạn 3 chất X có thể lấy là H2O.
c) Khi bị bỏng sulfuric acid thì thao tác đầu tiên là nhanh chóng rửa ngay với nước lạnh nhiều lần.
d) Để xác định công thức của một oleum (H2SO4.nSO3), người ta pha loãng 8,36 gam oleum đó vào nước thành 1,0 lít dung dịch sulfuric acid, sau đó tiến hành chuẩn độ mỗi 10,0 mL dung dịch acid này bằng dung dịch NaOH 0,10M. Thể tích dung dịch NaOH trung bình cần sử dụng để chuẩn độ là 20,01 mL. Giá trị của n xác định được là 3.
Câu trả lời tốt nhất
Câu 1.
(a) Sai, có 3 phản ứng oxi hóa khử (S, FeS2 tạo SO2 và SO2 tạo SO3).
(b) Sai, X là H2SO4 đặc.
(c) Sai. Nồng độ SO2 = 0,018/50 = 3,6.10^-4 mg/L = 3,6.10^-4 g/m³ = 360 μg/m³ > 350 μg/m³ nên không khí ở đó đã bị ô nhiễm.
(d) Đúng.
Câu 2.
(a) Sai, giai đoạn 1, 2 là các phản ứng oxi hóa khử. Giai đoạn 3 không có phản ứng oxi hóa khử.
(b) Sai, dùng nước sẽ tỏa nhiều nhiệt làm H2SO4 chuyển thành dạng sương mù, ăn mòn mạnh và khó hòa tan.
(c) Đúng, nước làm loãng và rửa trôi acid, nước cũng sẵn có nhất nên có thể rửa ngay lập tức.
(d) Sai: nNaOH = 2,001 mmol —> nH2SO4 (10 mL) = 1 mmol
—> nH2SO4 (1 L) = 100 mmol = 0,1 mol
Bảo toàn S —> (n + 1).8,36/(80n + 98) = 0,1
—> n = 4

