Thiết kế một pin điện hóa bằng cách nhúng thanh Zn và thanh Cu (không tiếp xúc với nhau) vào cốc đựng dung dịch H2SO4 loãng. Nối thanh kẽm và thanh đồng bằng dây dẫn (có một khóa X) như hình bên.
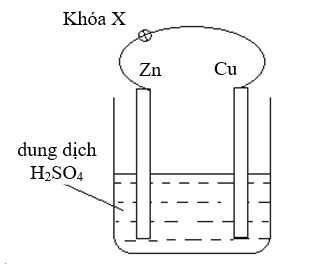
Cho các phát biểu sau:
(1) Khi mở khóa X có bọt khí thoát ra ở thanh Cu.
(2) Khi mở khóa X hay đóng khóa X thanh kẽm đều bị oxi hóa.
(3) Năng lượng hóa học dự trữ trong các chất phản ứng chủ yếu được chuyển hóa thành năng lượng điện khi pin hoạt động.
(4) Khi đóng khóa X thanh kẽm đóng vai trò cực âm của pin điện và bị oxi hóa.
(5) Khi thay thanh Cu bằng thanh Mg thì có dòng electron dịch chuyển từ Zn sang Mg.
(6) Cho thêm vào cốc dung dịch CuSO4 thấy cực Zn tan nhanh hơn, khối lượng cực Cu tăng đồng thời bọt H2 thoát ra ở cực Cu nhiều hơn
Số phát biểu đúng là
A. 5. B. 2. C. 3. D. 4.
Câu trả lời tốt nhất
(1) Sai, khi khóa X mở, thanh Zn và Cu không còn liên kết gì với nhau, Cu không phản ứng với H2SO4 loãng nên không có bọt khí.
(2) Đúng, khi khóa X mở, thanh Zn bị ăn mòn hóa học. Khi khóa X đóng, thanh Zn bị ăn mòn hóa học và ăn mòn điện hóa.
(3) Đúng, khi pin hoạt động, có dòng điện chạy qua dây dẫn. Đây là năng lượng hóa học dự trữ trong các chất phản ứng.
(4) Đúng, Zn có tính khử mạnh hơn Cu nên Zn là cực âm và bị oxi hóa.
(5) Sai, thay thanh Cu bằng Mg thì Mg lại là cực âm (do Mg có tính khử mạnh hơn Zn), khi đó có dòng electron dịch chuyển từ Mg sang Zn thông qua dây dẫn.
(6) Sai, thêm Cu2+ vào dung dịch sẽ khiến một lượng Cu bám vào Zn (do Zn bị ăn mòn hóa học), khi đó electron từ Zn chủ yếu di chuyển ngay sang Cu vừa bám vào (do điện trở nhỏ hơn vì tiếp xúc trực tiếp), chỉ có phần nhỏ di chuyển sang điện cực Cu ban đầu, vì vậy bọt khí thoát ra bên cực Cu này giảm hẳn.

