Thực hiện hai thí nghiệm với cùng một lượng bột CaCO3 cho tác dụng với lượng dư dung dịch HCl có nồng độ khác nhau. Thể tích khí CO2 thoát ra theo thời gian được ghi lại trên đồ thị (hình bên).
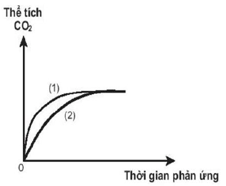
a) Thí nghiệm nào đã dùng dung dịch HCl có nồng độ cao hơn? Giải thích.
b) So sánh thể tích khí CO2 thu được trong hai thí nghiệm sau khi phản ứng kết thúc. Giải thích. Biết khí CO2 sinh ra trong cả hai thí nghiệm được thu ở cùng điều kiện nhiệt độ và áp suất, các phản ứng xảy ra hoàn toàn.
c) Đề xuất ba biện pháp làm tăng tốc độ phản ứng khi cho CaCO3 tác dụng với dung dịch HCl.
Câu trả lời tốt nhất
Phản ứng: CaCO3 + 2HCl —> CaCl2 + CO2 + H2O
(a) Thí nghiệm (1) dùng dung dịch HCl có nồng độ cao hơn vì tốc độ thoát khí trong thí nghiệm (1) lớn hơn (đồ thị có độ dốc lớn hơn). Nồng độ càng cao thì tốc độ phản ứng diễn ra càng nhanh.
(b) Lượng CO2 thu được trong cả 2 thí nghiệm bằng nhau vì lượng CaCO3 bằng nhau và lượng HCl đều dư.
Khi đó CaCO3 tan hết và nCO2 = nCaCO3. Trong cùng điều kiện nhiệt độ và áp suất, các khí có số mol bằng nhau sẽ có thể tích như nhau.
(c) Các biện pháp làm tăng tốc độ phản ứng giữa CaCO3 và HCl:
+ Dùng CaCO3 dạng bột mịn: Diện tích tiếp xúc tăng sẽ làm tốc độ phản ứng tăng.
+ Dùng dung dịch HCl có nồng độ cao hơn: Nồng độ càng cao tốc độ phản ứng càng cao.
+ Đun nóng hỗn hợp phản ứng: Nhiệt độ càng cao, tốc độ phản ứng càng nhanh.

