Trong trường hợp tổng quát, pin Galvani được ký hiệu như sau: (-) A | An+ | | Bm+ | B (+)
Trong đó dấu | | chỉ cầu muối, A | An+ và Bm+ | B là các điện cực kim loại được nhúng vào dung dịch muối tương ứng của chúng. Thế điện cực của các cặp oxi hóa – khử được tính theo phương trình Nernst:
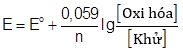
Trong đó: n là số electron trao đổi của cặp oxi hóa khử; E° là thế điện cực chuẩn của cặp oxi hóa – khử đó.
Cho pin điện hoá: (-) Zn | Zn(NO3)2 0,2M | | AgNO3 0,1M | Ag (+)
Biết các dung dịch Zn(NO3)2 và AgNO3 trong pin điện đều có thể tích 1,000 L và ở 25°C, thế điện cực chuẩn của E°Zn2+/Zn = -0,762V và E°Ag+/Ag = +0,799V.
a. Viết các quá trình xảy ra ở mỗi điện cực, phản ứng khi pin hoạt động.
b. Tính sức điện động của pin thời điểm ban đầu.
Câu trả lời tốt nhất
(a)
Tại anode: Zn —> Zn2+ + 2e
Tại cathode: Ag+ + 1e —> Ag
Phản ứng: Zn + 2Ag+ —> Zn2+ + 2Ag
(b)
EZn2+/Zn = E°Zn2+/Zn + ½.0,059lg[Zn2+] = -0,783V
EAg+/Ag = E°Ag+/Ag + 0,059lg[Ag+] = 0,740V
—> Epin = EAg+/Ag – EZn2+/Zn = 1,523V

