Trong quá trình ăn mòn điện hóa hợp kim của sắt, sự ăn mòn xảy ra khi sắt bị oxi hóa tại anode, trong khi phản ứng xảy ra tại catot với sự hiện diện của oxi và độ ẩm.
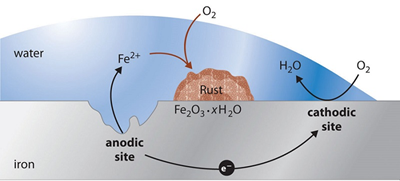
(1) Ở anode, sắt bị oxi hóa thành ion Fe²⁺, trong khi ở cathode, oxygen bị khử tạo thành ion hydroxide (OH⁻), dẫn đến sự hình thành gỉ sét.
(2) Độ ẩm giúp tạo một lớp điện ly mỏng, cho phép các ion di chuyển tự do, hỗ trợ quá trình ăn mòn.
(3) Các vùng kim loại bị trầy xước hoặc chịu tác động cơ học có xu hướng trở thành anode, dễ bị ăn mòn hơn.
(4) Khi hai kim loại khác nhau tiếp xúc trong môi trường ẩm, ăn mòn điện hóa được hình thành, với kim loại ít hoạt động hơn bị ăn mòn trước.
(5) Việc phủ lớp kẽm (mạ kẽm) có thể bảo vệ sắt nhờ vào lớp phủ hy sinh này, trong khi mạ thiếc có thể thúc đẩy ăn mòn nếu lớp phủ bị tổn thương.
Câu trả lời tốt nhất
(1) Đúng:
Anode: Fe —> Fe2+ + 2e
Cathode: O2 + 2H2O + 4e —> 4OH-
(2) Đúng, độ ẩm cung cấp H2O cho cathode và tạo môi trường điện ly hỗ trợ quá trình ăn mòn.
(3) Đúng, bề mặt trầy xước có bề mặt thô ráp, diện tích tiếp xúc lớn, dễ bị ăn mòn xoáy sâu và rộng ra.
(4) Sai, kim loại hoạt động mạnh hơn bị ăn mòn trước.
(5) Đúng, phủ kẽm hoặc thiếc ban đầu là phương pháp bảo vệ bệ mặt nhưng chuyển đổi nhanh chóng do bị sứt, thủng trong quá trình sử dụng. Khi đó Zn mạnh hơn sẽ bảo vệ lớp sắt, ngược lại lớp bảo vệ Sn lại trở thành “kẻ phá hoại” khiến sắt (mạnh hơn Sn) bị ăn mòn.
