Ascorbic acid (vitamin C) là một acid hữu cơ được kí hiệu đơn giản là HAsc. Hàm lượng HAsc trong các loại đồ uống thể thao có thể xác định được bằng cách chuẩn độ với dung dịch iodine. Phương trình phản ứng có thể được biểu diễn như sau:
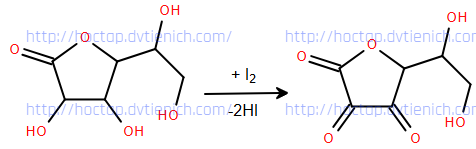
a) Xác định công thức phân tử của HAsc.
b) Tính pH của dung dịch khi hòa tan 10 gam HAsc vào 500 gam nước. Biết HAsc có hằng số phân li Ka1 = 7,9.10^-5; Ka2 = 10^-12 cho quá trình ion hóa thứ hai. Xem thể tích của dung dịch thay đổi không đáng kể.
c) Lấy 25 mL một mẫu đồ uống thể thao tiến hành chuẩn độ thì cần dùng 29,25 mL dung dịch I2 0,00125 M để đạt đến điểm tương đương. Xác định khối lượng HAsc (bằng mg) trong chai đồ uống thể thao chứa 350 mL dung dịch.
Câu trả lời tốt nhất
(a) Công thức phân tử của HAsc là C6H8O6
(b) nHAsc = 0,0568 —> CM HAsc = 0,1136
Ka1 >> Ka2 nên cân bằng sau là chủ yếu:
HAsc ⇔ H+ + Asc-
0,1136
x………x……….x
0,1136-x….x……x
Ka = x²/(0,1136 – x) = 7,9.10^-5
—> x = 2,956.10^-3
pH = -lgx = 2,53
(c)
25.CM C6H8O6 = 29,25.0,00125 —> CM C6H8O6 = 1,4625.10^-3 mol/L
—> mC6H8O6 trong 350 mL = 176.0,35.1,4625.10^-3 = 0,09009 gam = 90,09 mg
