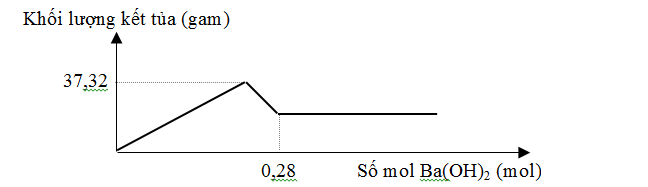
Cho m gam hỗn hợp gồm Na2O và Al2O3 vào 400 ml dung dịch H2SO4 0,3M và HCl 0,9M. Sau khi kết thúc phản ứng, thu được dung dịch X. Cho dung dịch Ba(OH)2 dư vào X, phản ứng được biểu diễn theo đồ thị sau:
Giá trị của m là?
A. 16,04 gam B. 17,2 gam C. 11,08 gam D. 9,84 gam
Câu trả lời tốt nhất
nH2SO4 = 0,12 và nHCl = 0,36
—> nBaSO4 max = 0,12
—> nAl(OH)3 max = 0,12
Do kết tủa max vẫn có Al(OH)3 —> Dung dịch X phải có Al3+ —> Dung dịch X không có OH- và không có AlO2-.
X chứa Al3+ (0,12), Na+ (a), H+ dư (b); Cl- (0,36); SO42- (0,12)
Bảo toàn điện tích cho X:
a + b + 0,12.3 = 0,36 + 0,12.2 (1)
Khi nBa(OH)2 = 0,28 hay nOH- = 0,56 thì Al(OH)3 đã bị hòa tan hoàn toàn nên:
0,56 – b = 0,12.4 (2)
Giải hệ (1)(2) —> a = 0,16 và b = 0,08
Vậy ban đầu nNa2O = a/2 = 0,08 và nAl2O3 = 0,12/2 = 0,06
—> m = 11,08
sao biết X không còn Alo2- vậy ạ? Na2o vào axit thì phải tác dụng td axit trc chứ sao tạo kiềm trc ạ?
e muốn hỏi là nếu dung dịch chứa H+ dư thì đồ thị bắt đầu phải cách gốc tọa độ một khoảng chứ ạ

