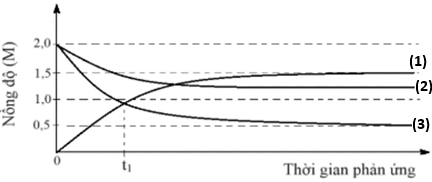
Cho phản ứng thuận nghịch: 2NO(g) + O2(g) ⇋ 2NO2(g). Nghiên cứu phản ứng với thành phần ban đầu chỉ có NO và O2, đường cong biểu diễn sự thay đổi nồng độ các chất theo thời gian phản ứng như sau:
Cho các phát biểu sau
(a) Đường (1) là nồng độ NO, đường (2) là nồng độ O2 và đường (3) là nồng độ NO2.
(b) Hằng số cân bằng nồng độ của phản ứng là Kc = 7,2.
(c) Phản ứng đạt đến trạng thái cân bằng tại thời điểm t1.
(d) Tỉ lệ nồng độ của NO và O2 không thay đổi trong quá trình phản ứng.
Các phát biểu đúng là
A. (b). B. (b), (c). C. (c), (d). D. (a), (b), (c).
Câu trả lời tốt nhất
(a) Sai, đường (1) ứng với nồng độ tăng nên là của NO2. Đường (2)(3) nồng độ giảm, trong đó (3) giảm gấp đôi (2) nên (2) là O2, (3) là NO.
(b) Đúng
Ban đầu: NO (2M), O2 (2M)
Cân bằng: NO2 (1,5M), NO (0,5M), O2 (1,25M)
—> Kc = 1,5²/(0,5².1,25) = 7,2
(c) Sai, ban đầu tỉ lệ NO và O2 là 1 : 1 nhưng khi tham gia phản ứng lượng tiêu thụ của chúng khác nhau nên lượng còn lại có tỉ lệ thay đổi, khác 1 : 1.

