Cho pin điện hóa được thiết lập bởi điện cực Zn và điện cực hydrogen (cấu tạo như hình vẽ) dung dịch Zn (aq) 1 M và dung dịch H+ (aq) 1 M có thể tích bằng nhau, sức điện động chuẩn của pin đo được là 0,76 V.
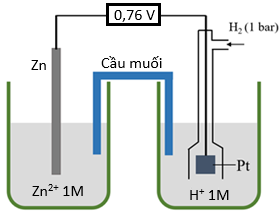
a) Thế điện cực chuẩn của cặp oxi hóa – khử Zn2+/Zn là 0,76 V.
b) Pin hoạt động đến khi nồng độ Zn2+ trong dung dịch là 1,1 M thì nồng độ H+ là 0,8 M.
c) Tại điện cực dương xảy ra quá trình khử ion H+ (aq) thành khí H2.
d) Phản ứng xảy ra trong pin là H2(g) + Zn2+(aq) → Zn(s) + 2H+(aq).
Câu trả lời tốt nhất
(a) Sai:
E°pin = E°2H+/H2 – E°Zn2+/Zn = 0,76V
E°2H+/H2 = 0 —> E°Zn2+/Zn = -0,76V
(b) Đúng: Zn + 2H+ —> Zn2+ + H2 nên nồng độ Zn2+ tăng 0,1M thì nồng độ H+ giảm 0,2M (còn 0,8M)
(c) Đúng, tại cực dương (cathode): 2H+ + 2e —> H2
(d) Sai, phản ứng đúng là:
Zn(s) + 2H+(aq) —> Zn2+(aq) + H2(g)

