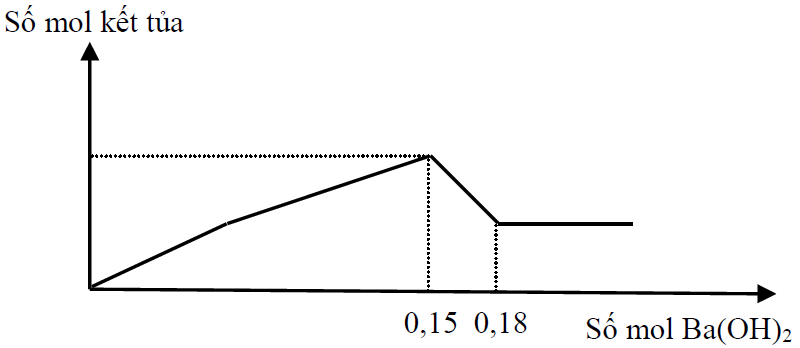
Cho từ từ đến dư dung dịch Ba(OH)2 vào dung dịch X chứa H+, Cr3+, Cl- và SO42-. Phản ứng được biểu diễn theo đồ thị sau:
Nếu nhúng thanh Zn vào dung dịch X trên, kết thúc phản ứng lấy thanh Zn ra, lau khô cân lại thấy khối lượng giảm m gam so với ban đầu. Giá trị m là.
A. 9,75 gam. B. 11,7 gam.
C. 3,90 gam. D. 5,85 gam.
Câu trả lời tốt nhất
Kết tủa giảm từ max xuống min khi nBa(OH)2 = 0,18 – 0,15 = 0,03
—> nCr3+ = nCr(OH)3 max = 0,06
Khi kết tủa đạt max thì nOH- = 0,3
—> nOH- = nH+ + 3nCr(OH)3 max —> nH+ = 0,12
Bảo toàn electron: 2nZn = nH+ + nCr3+
—> nZn = 0,09
—> mZn = 5,85 gam
Đoạn cuối bảo toàn e phải là 2nZn=nH+ + 3n cr3+ chứ a. mol zn là 0,15 mzn = 9,75.
ad cho e hỏi 2 vđ này với ạ
?1. Tại s lại là 2Zn=H+ + Cr3+. E tưởng H+ xg H2 phải là 2Zn=2H+ + Cr3+
?2. Nếu điểm cao nhất là cả 2 kết tủa cùng max thì e tính ra Cl-=0 là s v ạ
Em cám ơn ad trc ạ ?

