Cho từ từ dung dịch Ba(OH)2 đến dư vào dung dịch chứa x mol Na2SO4 và y mol AlCl3, sự phụ thuộc của số mol kết tủa và số mol Ba(OH)2 được biểu diễn theo đồ thị sau:
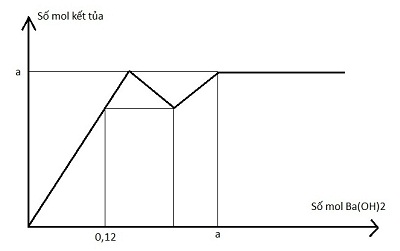
Giá trị của x + y là:
A. 0,35 B. 0,3 C. 0,4 D. 0,45
Câu trả lời tốt nhất
Đoạn 1:
Ba2+ + SO42- —> BaSO4
3OH- + Al3+ —> Al(OH)3
Kết thúc đoạn 1 kết tủa gồm Al(OH)3 (y mol) và BaSO4 (1,5y) —> a = 2,5y
Khi nBa(OH)2 = 0,12 —> nBaSO4 = 0,12 và nAl(OH)3 = 0,08
—> n↓ tại điểm này = 0,2
Đoạn 2:
Ba2+ + SO42- —> BaSO4
OH- + Al(OH)3 —> AlO2- + 2H2O
(Đoạn 2 cứ tạo ra 1 mol BaSO4 thì lại hòa tan 2 mol Al(OH)3 nên tổng mol kết tủa giảm).
Đoạn 1 + đoạn 2 đã dùng hết 4y mol OH- hay 2y mol Ba(OH)2
—> nBaSO4 = 2y = 0,2 —> y = 0,1
Đoạn 3:
Ba2+ + SO42- —> BaSO4
Trong cả 3 đoạn đã dùng hết nBa(OH)2 = 2,5y
—> nBaSO4 max = x = 2,5y —> x = 0,25
Vậy x + y = 0,35
thầy ơi, đoạn 2 chỗ tạo 1 mol baso4 và hòa tan 2 mol al(oh)3 thì đúng ra kết tủa phải tăng chứ thầy, 233-78×2=77 chứ ạ

