Điện phân hỗn hợp dung dịch NaCl và CuSO4 với điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi. Giả sử hiệu suất điện phân là 100%, quá trình điện phân nước không bay hơi. Số mol Cu bám vào catot, tổng số mol khí thoát ra ở hai điện cực và số mol MgO bị hoà tan bởi dung dịch sau điện phân được cho ở bảng sau:
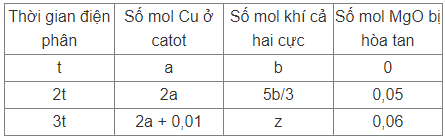
Cho các kết luận:
(a) Giá trị a và b bằng nhau.
(b) Giá trị z = 0,225.
(c) Số mol CuSO4 ban đầu là 0,16.
(d) Số mol NaCl ban đầu là 0,2.
Số kết luận đúng là
A. 4. B. 1. C. 2. D. 3.
Câu trả lời tốt nhất
Dung dịch sau điện phân hòa tan MgO (có H+) nên phản ứng điện phân là:
CuSO4 + 2NaCl —> Cu + Cl2 + Na2SO4 (1)
CuSO4 + H2O —> Cu + ½O2 + H2SO4 (2)
Thời điểm t giây nMgO = 0 —> nH+ = 0 —> Chỉ có (1) —> a = b —> (a) đúng.
Thời điểm 2t giây: nH2SO4 = nMgO = 0,05
(2) —> nO2 = 0,025 —> nCl2 = 5a/3 – 0,025
Bảo toàn electron: 2.2a = 0,025.4 + 2(5a/3 – 0,025)
—> a = 0,075
ne trong t giây = 2a = 0,15 —> ne trong 3t giây = 0,45
Thời điểm 3t giây:
Catot: nCu = 2a + 0,01 = 0,16 —> nH2 = 0,065
Anot: nCl2 = 5a/3 – 0,025 = 0,1 —> nO2 = 0,0625
—> z = nH2 + nCl2 + nO2 = 0,2275 —> (b) sai
nCuSO4 ban đầu = nCu max = 0,16 —> (c) đúng
nNaCl ban đầu = 2nCl2 = 0,2 —> (d) đúng

