Hai học sinh tiến hành nghiên cứu phản ứng thuận nghịch:
[CoCl4]2-(aq) + 6H2O(l) ⇋ [Co(H2O)6]2+(aq) + 4Cl-(aq) (1)
(màu xanh) (màu hồng)
Hai học sinh đặt ra giả thuyết: “khi tăng nhiệt độ thì cân bằng hóa học chuyển dịch theo chiều thuận” và tiến hành như sau:
Hai học sinh chuẩn bị dung dịch đã đạt cân bằng hóa học theo phương trình (1) ở nhiệt độ phòng. Một học sinh tiến hành đun nóng 20 cm³ dung dịch đến 50°C, trong khi học sinh còn lại đun nóng 20 cm³ dung dịch đến 90°C. Cả hai học sinh sử dụng phương pháp trắc quang để theo dõi sự thay đổi màu sắc của dung dịch theo thời gian. Thiết bị đo màu được cài đặt sao cho độ hấp thu chỉ phụ thuộc vào nồng độ ion [Co(H2O)6]2+.
Độ hấp thu càng lớn thì nồng độ ion [Co(H2O)6]2+ càng cao. Độ hấp thu ban đầu được đặt là 0 và các giá trị được ghi lại sau mỗi 30 giây.
Kết quả được mô tả bằng đồ thị độ hấp thụ theo thời gian.
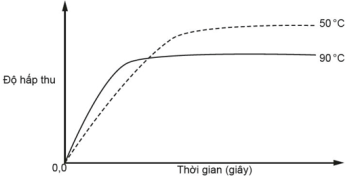
a) Từ kết quả thí nghiệm cho thấy giả thuyết của hai học sinh ban đầu là đúng.
b) Phản ứng (1) có giá trị của ΔrH lớn hơn 0.
c) Trong điều kiện thí nghiệm, nếu cho thêm HCl vào thì độ hấp thu đo được của dung dịch giảm.
d) Trong hai ion phức [CoCl4]2- và [Co(H2O)6]2+, Cobalt đều có số oxi hóa +2.
Câu trả lời tốt nhất
(a) Sai, dựa theo đồ thị thì độ hấp thu ở 50°C cao hơn ở 90°C, tức là nhiệt độ càng cao thì nồng độ [Co(H2O)6]2+ càng giảm, cân bằng chuyển dịch theo chiều nghịch, trái ngược với giả thuyết đưa ra nên giả thuyết này là sai.
Lưu ý: Các đường cong đi lên từ điểm 0 mặc dù ban đầu đã có sẵn [Co(H2O)6]2+ là một đặc tính của máy đo. Máy đo không thể đột ngột “bắt” ngay cường độ màu hiện có của [Co(H2O)6]2+ trong dung dịch mà cần thời gian để nhận diện, vì vậy thời gian đầu độ hấp thu tăng vọt mặc dù [Co(H2O)6]2+ đang trên đà giảm xuống. Khi đọc kết quả phải bỏ qua giai đoạn máy “chạy đà” này.
(b) Sai, chiều thuận tỏa nhiệt nên (1) có giá trị của ΔrH < 0.
(c) Đúng, thêm HCl cân bằng sẽ chuyển dịch theo chiều nghịch, [Co(H2O)6]2+ giảm dần nên độ hấp thu đo được của dung dịch giảm.
(d) Đúng
Kiến thức chương trình phổ thông thì làm sao biết được cơ chế hoạt động của máy ạ
Nếu không chú thích rõ mà chỉ theo đề bài thì em tưởng [Co(OH2)6]2+ tăng do độ hấp phụ cao

