Hòa tan hết 34,6 gam hỗn hợp gồm Na, Na2O, Ba và BaO vào nước dư, thu được dung dịch X và a mol khí H2. Sục khí CO2 dư vào dung dịch X, phản ứng được biểu diễn theo sơ đồ sau:
Nếu cho 34,6 gam hỗn hợp trên vào 300 ml dung dịch H2SO4 0,4M và HCl 0,6M. Kết thúc phản ứng, thu được dung dịch Y có khối tăng x gam so với dung dịch ban đầu. Giá trị của x là
A. 11,02. B. 6,36.
C. 13,15. D. 6,64.
Câu trả lời tốt nhất
Hỗn hợp ban đầu chứa Na (x), Ba (y), O (z)
—> 23x + 137y + 16z = 34,6 (1)
Bảo toàn electron: x + 2y = 2z + 2a (2)
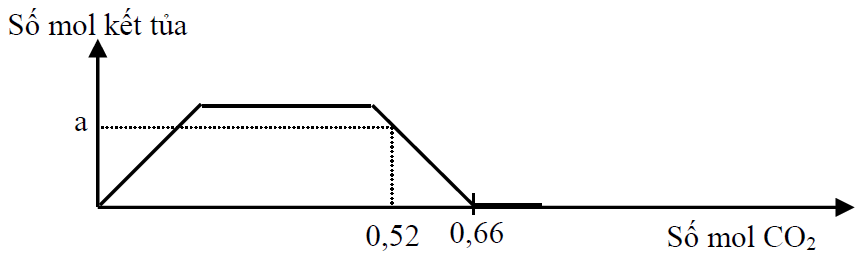
Trên đồ thị, khi nCO2 = 0,66 thì kết tủa bị hòa tan hết —> nHCO3- = 0,66
Bảo toàn điện tích —> x + 2y = 0,66 (3)
Tại nCO2 = 0,52 thì kết tủa bị hòa tan một phần.
nBaCO3 = a —> nBa(HCO3)2 = y – a
nNaHCO3 = x
Bảo toàn C —> a + 2(y – a) + x = 0,52 (4)
(1)(2)(3)(4): x = 0,3; y = 0,18; z = 0,19; a = 0,14
nH2SO4 = 0,12 —> nBaSO4 = 0,12
Δm = 34,6 – mBaSO4 – mH2 = 6,36
—> Tăng 6,36
Làm sao biết ở phần 2 là tương ứng với số mol ban đầu vậy ạ
Thưa thầy , đề bài hỏi là cho 34.6 gam X là NaOH và Ba(OH)2 tác dụng với hỗn hợp acid thì mol NaOH và mol Ba(OH)2 khác 0.3 & 0.18 đúng không ạ .
Em tưởng tính khối lượng tăng là : m = + m acid – m kết tủa ?
E tính theo H+=2nO + 2H2 thì có vđ ở đâu v ạ. Ad gt giúp e vs đc k ạ
tại sao em lấy khối lượng dung dịch sau ( tức là có 0,06mol Ba2+, 0,18 mol Cl-, và 0,3 mol Na+) trừ đi khối lượng dung dịch ban đầu ( tức là có 0,42 mol H+, 0,12 mol SO42-, và 0,18 mol Cl-) thì lại ra là 3,18g , không biết em sai ở đâu, hay thíếu chỗ nào ạ?

