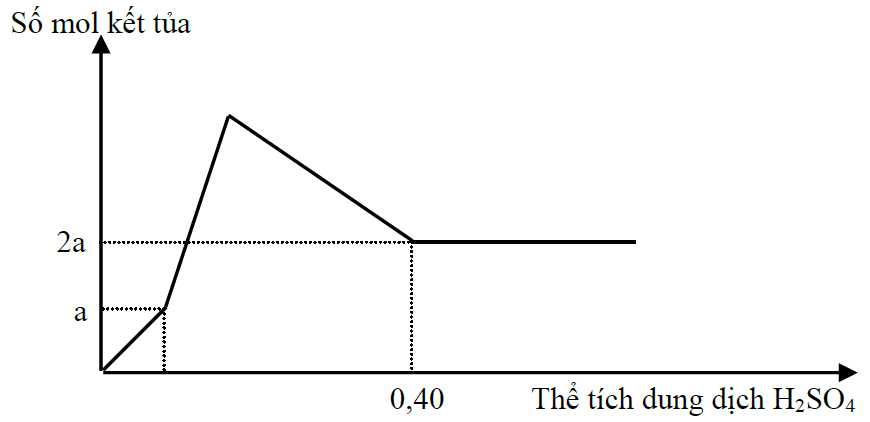
Hòa tan hết m gam hỗn hợp gồm Ba, BaO, Al và Al2O3 trong nước dư, thu được a mol H2 và dung dịch X. Cho từ từ dung dịch H2SO4 1M vào dung dịch X, phản ứng được biểu diễn theo đồ thị sau:
Giá trị của m là.
A. 31,36 gam. B. 32,64 gam.
C. 40,80 gam. D. 39,52 gam.
Câu trả lời tốt nhất
Đồ thị chia thành 4 đoạn:
Đoạn 1: Trung hòa OH- dư, kết tủa chỉ có BaSO4 (a mol)
—> nOH- = 2a mol
Đoạn 2 tạo đồng thời BaSO4 và Al(OH)3, đoạn 3 hòa tan hết Al(OH)3.
—> nBa2+ = nBaSO4 max = 2a
Đoạn 4: Khi nH+ = 0,8 thì kết tủa không thay đổi
—> nH+ = nOH- + 4nAlO2-
—> nAlO2- = 0,2 – 0,5a
Bảo toàn điện tích cho X: 2nBa2+ = nOH- + nAlO2-
—> 2.2a = 2a + 0,2 – 0,5a —> a = 0,08
Hỗn hợp ban đầu chứa Ba (2a = 0,16), Al (0,2 – 0,5a = 0,16) và O.
Bảo toàn electron: 2nBa + 3nAl = 2nH2 + 2nO
—> nO = 0,32
—> m = 31,36

