Hydrogen (H2) là một loại khí có nhiệt cháy cao nhất trong tất cả các loại nhiên liệu trong thiên nhiên. So với các nguồn nhiên liệu khác như xăng, dầu và khí đốt thì sản phẩm cháy của phân tử hydrogen chỉ có H2O nên được gọi là nhiên liệu sạch lý tưởng. Do đó việc giảm giá thành và các tác động đến môi trường trong quá trình sản xuất H2 là một thách thức to lớn. Cho phản ứng phân hủy H2O ở hai trạng thái như sau:
2H2O(l) → 2H2(g) + O2(g) (1)
2H2O(g) → 2H2(g) + O2(g) (2)
Cho bảng số liệu sau:
Hợp chất…………. H2(g)……. H2O(l)…… H2O(g)….. O2(g)
 (kJ/mol)… 0……….. -285,8……… -241,8……. 0
(kJ/mol)… 0……….. -285,8……… -241,8……. 0
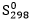 (J/mol.K)…… 130,6……… 69,9……… 188,7……. 205,2
(J/mol.K)…… 130,6……… 69,9……… 188,7……. 205,2
a. Tính 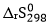 của hai phản ứng trên.
của hai phản ứng trên.
b. Hai phản ứng trên là phản ứng tỏa nhiệt hay thu nhiệt?
c. Tính 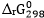 của hai phản ứng trên. Nhận xét về kết quả tính toán được.
của hai phản ứng trên. Nhận xét về kết quả tính toán được.
Câu trả lời tốt nhất
(a)
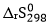 (1) = 130,6.2 + 205,2 – 2.69,9 = 326,6 J/K = 0,3266 kJ/K
(1) = 130,6.2 + 205,2 – 2.69,9 = 326,6 J/K = 0,3266 kJ/K
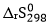 (2) = 130,6.2 + 205,2 – 2.188,7 = 89 J/K = 0,089 kJ/K
(2) = 130,6.2 + 205,2 – 2.188,7 = 89 J/K = 0,089 kJ/K
(b)
 (1) = 2.285,8 = 571,6 kJ > 0 nên (1) thu nhiệt.
(1) = 2.285,8 = 571,6 kJ > 0 nên (1) thu nhiệt.
 (2) = 2.241,8 = 483,6 kJ > 0 nên (2) thu nhiệt.
(2) = 2.241,8 = 483,6 kJ > 0 nên (2) thu nhiệt.
(c)
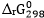 (1) = 571,6 – 298.0,3266 = 474,2732 kJ
(1) = 571,6 – 298.0,3266 = 474,2732 kJ
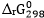 (2) = 483,6 – 298.0,089 = 457,078 kJ
(2) = 483,6 – 298.0,089 = 457,078 kJ
Cả 2 giá trị 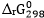 trên đều rất dương nên phản ứng (1)(2) rất khó xảy ra.
trên đều rất dương nên phản ứng (1)(2) rất khó xảy ra.

