Ammonia được tổng hợp theo phản ứng: N2(g) + 3H2(g) ⇋ 2NH3(g). Kết quả nghiên cứu sự phụ thuộc của hiệu suất phản ứng tổng hợp ammonia (N2 và H2 được lấy theo tỉ lệ mol tương ứng là 1 : 3) vào áp suất và nhiệt độ được thể hiện ở giản đồ bên.
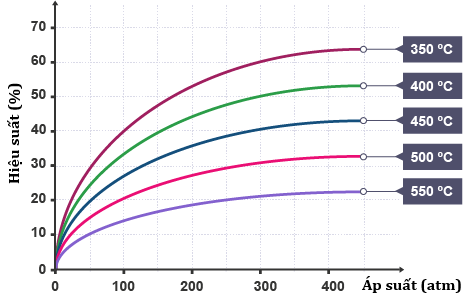
Dựa vào giản đó bên ta có:
a) Phản ứng trên theo chiều thuận là phản ứng thu nhiệt ( > 0).
> 0).
b) Hiệu suất phản ứng tỉ lệ thuận với nhiệt độ và áp suất.
c) Nếu thêm chất xúc tác thì hiệu suất phản ứng tổng hợp NH3 sẽ cao hơn so với khi không có chất xúc tác.
d) Nếu thực hiện phản ứng ở áp suất là 300 atm và nhiệt độ 400°C thì hỗn hợp khí khi cân bằng có %VNH3 > 25%.
Câu trả lời tốt nhất
(a) Sai, khi tăng nhiệt độ thì hiệu suất tổng hợp NH3 giảm (cân bằng chuyển dịch theo chiều nghịch) nên chiều thuận là phản ứng tỏa nhiệt ( < 0).
< 0).
(b) Sai, hiệu suất phản ứng tỉ lệ thuận với áp suất, tỉ lệ nghịch với nhiệt độ.
(c) Sai, chất xúc tác làm hệ nhanh đạt đến trạng thái cân bằng, không ảnh hưởng đến áp suất.
(d) Đúng, ở áp suất là 300 atm và nhiệt độ 400°C thì H = 50%, ban đầu nN2 = 1 và nH2 = 3
Lúc cân bằng: nN2 = 0,5; nH2 = 1,5; nNH3 = 1 —> %V NH3 = 1/3 = 33,33%

