Một bình gas (khí hóa lỏng) chứa hỗn hợp propane (C3H8) và butane (C4H10) với tỉ lệ mol 1 : 2. Xác định nhiệt lượng tỏa ra khi đốt cháy hoàn toàn 12 kg khí gas trên ở điều kiện chuẩn (nhiệt độ 25°C hay 298K và áp suất 1 bar). Cho biết các phản ứng:
C3H8(g) + 5O2(g) → 3CO2(g) + 4H2O(l) 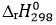 = -2220 kJ
= -2220 kJ
C4H10(g) + 6,5O2(g) → 4CO2(g) + 5H2O(l) 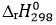 = -2874 kJ
= -2874 kJ
Trung bình mỗi ngày, một hộ gia đình cần đốt gas để cung cấp 10000 kJ nhiệt (hiệu suất hấp thụ nhiệt là 80%).
a) Sau bao nhiêu ngày hộ gia đình trên sẽ sử dụng hết bình gas 12 kg?
b) Giá gas là 440.000 đồng/bình 12 kg thì mỗi tháng hộ gia đình trên dùng hết bao nhiêu tiền gas (giả sử 1 tháng có 30 ngày)
c) Giả thiết rằng toàn bộ lượng nhiệt của quá trình đốt gas tỏa ra đều dùng để làm nóng nước với hiệu suất hấp thụ nhiệt khoảng 70%, hãy tính thể tích khí gas (ở điều kiện chuẩn) cần phải đốt để làm nóng 2 lít nước từ 25°C tới 100°C Biết để làm nóng 1 mol nước thêm 1°C cần một nhiệt lượng là 75,4 J; khối lượng riêng của nước là 1 gam/ml; ở điều kiện chuẩn 1mol khí có thể tích 24,79 lít.
Câu trả lời tốt nhất
(a) nC3H8 = x; nC4H10 = 2x
—> 44x + 58.2x = 12000 gam —> x = 75 mol
Số ngày sử dụng = 80%(2220x + 2874.2x)/10000 = 47,808 ngày
(b) 47,808 ngày dùng hết 440000 đồng tiền gas
—> 30 ngày dùng hết 30.440000/47,808 ≈ 276000 đ
(c) Lượng gas cần dùng chứa nC3H8 = y; nC4H10 = 2y
Bảo toàn năng lượng:
70%(2220y + 2874.2y).1000 = 75,4.(100 – 25).2000.1/18
—> y = 0,112653
—> V = 24,79.3y = 8,378 L
