Một loại máy đo đường huyết điện hóa hoạt động như sau:
– Khi một giọt máu cho lên dải thử, được phủ một lớp enzyme glucose oxidase (GOx) và chất trung gian [Fe(CN)6]3–) xảy ra phản ứng theo sơ đồ 1:
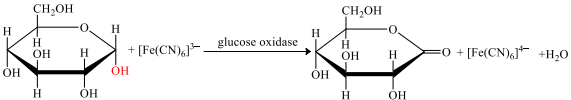
– Ion [Fe(CN)6]4– di chuyển đến điện cực thứ nhất, xảy ra phản ứng theo sơ đồ 2:
[Fe(CN)6]4– → [Fe(CN)6]3– + 1e
– Ở điện cực còn lại là một điện cực tham chiếu (AgCl/Ag), xảy ra phản ứng theo sơ đồ 3: AgCl + 1e → Ag + Cl–
Như vậy đã tạo ra dòng điện, các cảm biến đo dòng điện, chuyển đổi tín hiệu này thành nồng độ của glucose trong máu. Giả sử các quá trình xảy ra hoàn toàn, điện lượng của hệ trên theo phương trình Faraday: q = I.t = ne.F
Trong đó: q: tổng điện lượng (C); I: cường độ dòng điện (A); t: thời gian (s); ne: số mol electron trao đổi (mol); F: hằng số Faraday = 96485 C/mol.
– Biết thể tích giọt máu là 0,6 μL, thời gian đo của máy là 5s (chỉ có 1 phần glucose được chuyển hóa trong thời gian này), cường độ dòng điện đo được là 0,28 μA thì có kết quả Nồng độ glucose trong mẫu máu trên là 128 mg/dL
Tính % lượng glucose trong giọt máu đã phản ứng. (đơn vị %, làm tròn kết quả đến hàng phần trăm) (biết 1μ = 10–6)
Câu trả lời tốt nhất
Phản ứng tại vị trí giọt máu nhỏ trên dải thử được phủ một lớp enzyme GOx:
Glucose —> Gluconolactone + 2H+ + 2e
[Fe(CN)6]3– + 1e —> [Fe(CN)6]4-
Tiếp đó xảy ra quá trình điện phân chuyển đổi ngược [Fe(CN)6]4- lại thành [Fe(CN)6]3– tại anode.
Vậy: nGlucose phản ứng = ne/2 = It/2F
Với I = 0,28 μA = 2,8.10^-7 A
—> nGlucose phản ứng = 7,255014.10^-12 mol
V = 0,6 μL = 6.10^-6 dL
—> mGlucose ban đầu = 128.6.10^-6 = 7,68.10^-4 mg
%Glucose phản ứng = 180.7,255014.10^-12.1000/(7,68.10^-4) = 0,17%
Phản ứng sơ đồ (1) có gì sai không ạ, chỗ H2O phải là 2H+ thì mới cân bằng được chứ ad

