Một nhóm học sinh nghiên cứu ảnh hưởng của môi trường đến khả năng ăn mòn và tốc độ ăn mòn của kim loại và đưa ra giả thuyết “Tốc độ ăn mòn kim loại phụ thuộc vào nồng độ ion trong môi trường, nếu môi trường có nồng độ ion càng lớn thì tốc độ ăn mòn càng nhanh”. Để chứng minh giả thuyết, nhóm học sinh tiến hành thí nghiệm sau: Lấy ba đinh sắt (làm bằng thép carbon) có thành phần và kích thước như nhau vào ba cốc (như hình vẽ): Cốc 1 chứa 100 mL nước cất, cốc 2 chứa 100 mL dung dịch NaCl 5% và cốc 3 chứa 100 mL dầu nhờn. Để 3 cốc đó trong không khí, sau 5 ngày thấy đinh sắt trong cốc 1 bị gỉ ít, trong cốc 2 bị gỉ nhiều, trong cốc 3 không bị gỉ.
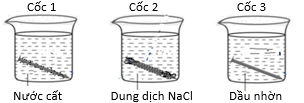
a) Ở cốc 3 đinh sắt không bị gỉ là do dầu nhờn không tạo ra dung dịch chất điện li.
b) Đinh sắt trong cốc 1 và 2 bị gỉ là do ăn mòn điện hóa trong đó chất oxi hóa là nước.
c) Đinh sắt trong cốc 2 bị gỉ nhiều hơn trong cốc 1 là do NaCl phản ứng với Fe.
d) Từ kết quả thí nghiệm chứng minh giả thuyết mà nhóm học sinh đưa ra là đúng.
Câu trả lời tốt nhất
(a) Đúng, cốc 3 đinh sắt không bị gỉ là do dầu nhờn không tạo ra dung dịch chất điện li và dầu nhờn ngăn O2 tiếp cận định sắt.
(b) Sai, các đinh sắt ở cốc 1, 2 bị ăn mòn điện hóa với chất oxi hóa đều là O2 hòa tan.
(c) Sai, NaCl không phản ứng với Fe, NaCl chỉ tạo điều kiện thuận lợi cho quá trình ăn mòn:
+ Dung dịch NaCl chứa các ion Na+, Cl- làm dung dịch dẫn điện tốt, thúc đẩy phản ứng điện hóa oxi hóa Fe thành Fe2+, Fe3+.
+ Ion Cl- có khả năng phân rã các lớp gỉ, giúp nước mang theo O2 thấm sâu và luồn lách vào trong.
(d) Đúng, trong phạm vi hẹp của thí nghiệm thì giả thuyết này chính xác, tuy nhiên không phải khi nào cũng vậy, vì:
+ Không giống Cl-, một số ion lại có khả năng bảo vệ kim loại do tạo lớp màng không tan như các ion PO43-, OH-, CO32-… (tùy kim loại).
+ Nồng độ ion quá cao sẽ làm giảm O2 hòa tan. O2 mới là nhân vật chính, O2 giảm hoặc mất hẳn thì kim loại cũng giảm khả năng bị ăn mòn.
+ Một số ion (SO42-, NO3-…) không sở hữu cả năng xâm lấn như Cl-, vì vậy nồng độ tăng cũng ít ảnh hưởng đến ăn mòn kim loại.

