Một nhóm học sinh tiến hành xác định biến thiên enthalpy của phản ứng giữa kim loại Mg với hydrochloric acid theo phản ứng: Mg(s) + 2HCl(aq) → MgCl2(aq) + H2(g) (1)
Biến thiên enthalpy của phản ứng được xác định một cách gần đúng bởi công thức sau: 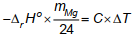
Trong đó: C là nhiệt lượng cần để tăng nhiệt độ của môi trường phản ứng lên 1°C; ∆T là nhiệt độ chênh lệch trong thí nghiệm; mMg là số gam Mg phản ứng. Nhóm học sinh tiến hành thí nghiệm theo các bước sau:
• Bước 1: Lấy 1000 gam nước cho vào bình cách nhiệt (nhiệt không thoát ra bên ngoài); cho tiếp 20 gam dung dịch HCl 14,6% vào ống đầu tròn và đặt nhiệt kế vào trong bình (xem hình vẽ). Dữ kiện được tính toán cho biết nhiệt lượng để nâng nhiệt độ của hệ phản ứng lên 1°C là 4205 J.
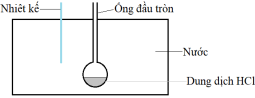
• Bước 2: Cho 0,5 gam bột Mg vào ống đầu tròn và ghi lại giá trị nhiệt độ cao nhất của nhiệt kế sau thí nghiệm. Thí nghiệm được lặp lại thêm hai lần nữa. Kết quả được thể hiện qua bảng sau:
Thí nghiệm………………… 1…… 2……. 3
Nhiệt độ ban đầu (°C)…. 25,0… 25,5… 26,0
Nhiệt độ cao nhất (°C)…. 27,3… 27,9… 28,4
a) Dựa vào công thức và kết quả thí nghiệm, nhóm học sinh xác định được biến thiên enthalpy của phản ứng (1) là ΔrH° = 464 kJ (Kết quả được làm tròn đến hàng đơn vị).
b) Nhiệt độ của nước và nhiệt kế tăng lên là do nước nhận được lượng nhiệt sinh ra từ phản ứng (1).
c) Giả thuyết nhóm học sinh đưa ra là “Phản ứng giữa kim loại magnesium (Mg) và dung dịch hydrochloric acid (HCl) là phản ứng tỏa nhiệt và có thể xác định được biến thiên enthalpy của phản ứng dựa trên sự thay đổi nhiệt độ của nước và nhiệt kế”.
d) Chênh lệch nhiệt độ trung bình của các thí nghiệm được xác định theo biểu thức: ∆T = Tmax – Tmin; trong đó Tmax là nhiệt độ cao nhất của ba thí nghiệm sau phản ứng; Tmin là nhiệt độ ban đầu thấp nhất của ba thí nghiệm trước phản ứng.
Câu trả lời tốt nhất
(a) Sai
Nhiệt độ ban đầu trung bình = 25,5°C
Nhiệt độ cao nhất trung bình = 418/15°C
ΔrH° = – C × ∆T / nMg = -4205(418/15 – 25,5) / (0,5/24) = -477688 J ≈ -478 kJ
(b) Đúng, bầu phản ứng tủa nhiệt làm nước trong bình cách nhiệt, nhiệt kế nóng lên.
(c) Đúng
(d) Sai, có 2 cách tính nhưng số liệu các thí nghiệm không đan chéo vào nhau mà độc lập với nhau:
+ Tính ∆T cho từng thí nghiệm và lấy ∆T trung bình của 3 thí nghiệm.
+ Tính nhiệt độ ban đầu trung bình, nhiệt độ cao nhất trung bình rồi tính ∆T từ kết quả này (như trên).

