Tiến hành điện phân dung dịch X chứa hỗn hợp CuSO4 và KCl (điện cực trơ, màng ngăn xốp) với cường độ dòng điện 5A không đổi thu được kết quả như bảng sau:
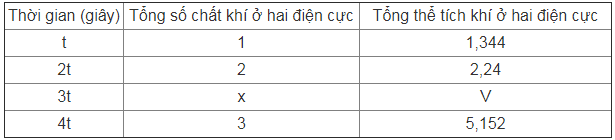
Giả sử hiệu suất của phản ứng điện phân là 100%, các khí sinh ra không tan trong nước và nước không bay hơi. Giá trị của V là
A. 3,584. B. 3,136. C. 2,912. D. 3,36.
Câu 2. Cho các phát biểu sau:
(a) Giá trị của m là 39,12 (gam).
(b) Khi thời gian điện phân là 3t (giây), ở catot đã có khí thoát ra.
(c) Giá trị của t là 2316 (giây).
(d) Khối lượng catot tăng 7,68 (gam) khi thời gian điện phân là 2t (giây).
(e) Giá trị của V là 3,136 (lít)
(f) Kết thúc điện phân (sau 4t giây), khối lượng dung dịch giảm 19,26 (gam).
Số phát biểu đúng là
A. 4. B. 6. C. 5. D. 3.
Câu trả lời tốt nhất
t giây, tại anot: nCl2 = 0,06 —> ne trong t giây = 0,12
2t giây thu được lượng khí không gấp đôi t giây nên khí là Cl2 (a) và O2 (b)
—> a + b = 0,1
và 2a + 4b = 0,12.2
—> a = 0,08 và b = 0,02
Lúc 4t giây (ne = 0,48)
Anot: nCl2 = 0,08 —> nO2 = 0,08
n khí tổng = 0,23 —> nH2 = 0,07
Bảo toàn electron cho catot —> nCu = 0,17
Lúc 3t giây (ne = 0,36)
Anot: nCl2 = 0,08 —> nO2 = 0,05
Catot: nCu = 0,17 —> nH2 = 0,01
—> n khí tổng = 0,14
—> V = 3,136 lít
Câu 2.
(a) Đúng: nCuSO4 = 0,17; nKCl = 0,16 —> m = 39,12
(b) Đúng (catot đã thoát 0,01 mol H2)
(c) Đúng, ne = 0,12 = It/F —> t = 2316s
(d) Đúng, lúc 2t giây catot có 0,12 mol Cu (7,68 gam) bám vào
(e) Đúng
(f) Đúng
Chỗ 4t chỉ có pư đp nước,
mà mol khí 4t hơn 3t là 0,12, mol e là 0,12 => mol H2 và O2 ở 4t lần lượt là 0,06 và 0,03
=> V = 5,125 -22,4(0,06 + 0,03) = 3,136 -> Đ.án B
Cách này có đc k nhỉ =))
Ad cho em hỏi tại sao lại suy ra nCl2 tối đa là 0,08 mol ạ, làm sao để biết được ở 3t(s) Cl- không bị điện phân thêm nữa ạ

