Tiến hành điều chế ethyl acetate theo các bước như hình sau
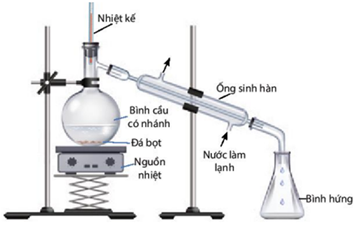
Bước 1: cho 10 mL ethanol (D = 0,78 g/cm³) cùng với 10 mL acetic acid (D = 1,05 g/cm³) và vài giọt dung dịch H2SO4 đặc, lắc đều bình cầu rồi lắp lên giá đỡ.
Bước 2: đun nóng bình cầu đến khoảng 70°C trong vòng 5 – 6 phút.
Bước 3: các chất thu được ở bình hứng được thêm tiếp vào 2 mL dung dịch sodium chloride bão hoà.
Hãy thực hiện các yêu cầu sau
a. Viết phương trình phản ứng xảy ra trong bình cầu khi đun nóng.
b. Vì sao chỉ đun hỗn hợp phản ứng đến khoảng 70°C mà không đun sôi hỗn hợp? Để kiểm soát nhiệt độ và quá trình sôi đồng đều, hãy đề xuất phương án phù hợp.
c. Cho biết vai trò của dung dịch sodium chloride bão hoà.
d. Đề xuất phương án thay thế ống sinh hàn, sau đó đánh giá hiệu quả giữa ống sinh hàn và phương án thay thế, giải thích ngắn gọn.
e. Ở 70°C phản ứng có Kc = 1. Cho 7,2 gam acetic acid tác dụng với 5,52 gam ethanol. Tính khối lượng ester thu được.
Câu 2.
a) Ở bước 2, trong bình cầu có phản ứng ester hóa sau:
CH3COOH + C2H5OH ⇌ CH3COOC2H5 + H2O (H2SO4 đặc, t°)
b) Giả sử hiệu suất của phản ứng đạt 40%, khối lượng ester thu được là 5,97 gam (kết quả đã được làm tròn đến hàng phần trăm).
c) Ở bước 3, dung dịch NaCl bão hòa có vai trò làm tăng hiệu suất phản ứng ester hóa.
d) Sau bước 2, các chất C2H5OH và CH3COOH vẫn còn trong bình cầu.
Câu trả lời tốt nhất
Câu 1.
(a) Phản ứng trong bình cầu khi đun nóng:
CH3COOH + C2H5OH ⇌ CH3COOC2H5 + H2O (H2SO4 đặc, t°)
(b) Chỉ đun hỗn hợp phản ứng đến khoảng 70°C mà không đun sôi hỗn hợp để hạn chế các chất tham gia phản ứng bị hay hơi, bị phân hủy hoặc bị H2SO4 đặc oxi hóa.
Để kiểm soát nhiệt độ ta dùng nhiệt kế, đọc giá trị nhiệt độ từ nhiệt kế và điều chỉnh nguồn nhiệt cho phù hợp.
Để kiểm soát quá trình sôi đồng đều ta cho vào bình cầu một ít đá bọt.
(c) Vai trò của dung dịch NaCl bão hoà để tăng khối lượng riêng của H2O giúp ester nổi lên hoàn toàn, tách lớp nhanh và thuận tiện khi chiết.
(d) Có thể thay ống sinh hàn bằng cách đun hồi lưu, tuy nhiên cách này hiệu suất thấp hơn do ester không được tách ra ngoài ngay, cân bằng không chuyển dịch nhiều sang chiều thuận.
(e) nCH3COOH = 0,12; nC2H5OH = 0,12
CH3COOH + C2H5OH ⇌ CH3COOC2H5 + H2O
0,12……………..0,12
x……………………x…………….x……………..x
0,12-x…………0,12-x………….x………………x
Kc = x²/(0,12 – x)² = 1 (Thể tích tự triệt tiêu)
—> x = 0,06
—> mCH3COOC2H5 = 88x = 5,28 gam
Câu 2.
(a) Đúng
(b) Đúng
nC2H5OH = 10.0,78/46 = 0,1696
nCH3COOH = 10.1,05/60 = 0,175
H = 40% —> mCH3COOC2H5 = 0,1696.40%.88 = 5,97 gam
(c) Sai, NaCl bão hòa không can thiệp gì vào phản ứng ester hóa (đã xảy ra trong bình cầu ở bước 2 trước đó). Thêm NaCl bão hòa giúp quá trình chiết ester thuận lợi.
(d) Đúng, phản ứng ester hóa thuận nghịch, không thể hoàn toàn nên các chất tham gia vẫn còn dư.

