Trong quá trình sản xuất sulfuric acid, sulfur dioxide được chuyển thành sulfur trioxide ở nhiệt độ 400 – 500°C theo phản ứng 2SO2(g) + O2(g) ⇋ 2SO3(g) ΔrH < 0.
Sau khi hệ đạt trạng thái cân bằng, một số yếu tố được thay đổi, kể cả thêm chất xúc tác, dẫn đến sự chuyển dịch trạng thái cân bằng như đồ thị bên.
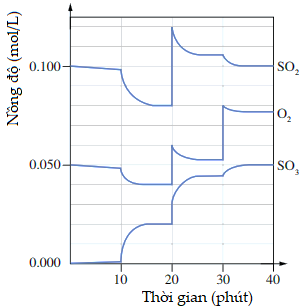
Cho các phát biểu sau:
(1) Biểu thức hằng số Kc của phản ứng Kc = p(SO3)²/[p(SO2)².p(O2)]
(2) Hệ đạt trạng thái cân bằng trong các khoảng thời gian: 15 – 20 phút, 25 – 30 phút, 35 – 40 phút.
(3) Tại thời điểm 18 phút, hệ đạt trạng thái cân bằng, có Kc = 0,02²/[0,08².0,04] = 1,5625 (L/mol)
(4) Tại thời điểm 20 phút đã thực hiện tăng áp suất bằng cách giảm thể tích của hệ, nên cân bằng chuyển dịch về phía thuận.
Số phát biểu đúng là
A. 2. B. 3. C. 4. D. 1.
Câu trả lời tốt nhất
(1) Sai, Kc = [SO3]²/[SO2]²[O2]
(2) Đúng, trong các khoảng thời gian này nồng độ các chất không thay đổi nên hệ đạt trạng thái cân bằng.
(3) Đúng, lúc 18 phút, dựa vào đồ thị ta có [SO3] = 0,02; [SO2] = 0,08 và [O2] = 0,04 nên Kc = 1,5625 (L/mol)
(4) Đúng
Trong giai đoạn hệ đạt trạng thái cân bằng (từ 15 – 20), nồng độ các chất là [SO3] = 0,02; [SO2] = 0,08 và [O2] = 0,04
Phút thứ 20 nồng độ các chất đột ngột tăng: SO3 (0,03), SO2 (0,12), O2 (0,06) (Số lần tăng như nhau: 0,03/0,02 = 0,12/0,08 = 0,06/0,04 = 1,5 lần) —> Đã nén lại với thể tích giảm 1,5 lần hoặc đồng loạt xả thêm 3 chất với lượng phù hợp.
Sau đó hệ đạt trạng thái cân bằng mới với nồng độ SO3 tăng nên cân bằng đã chuyển dịch theo chiều thuận.

