Chuẩn độ dung dịch HCl chưa biết nồng độ bằng dung dịch chuẩn NaOH 0,1M với chất chỉ thị màu phenolphthalein. Qua trình chuẩn độ dung dịch HCl và chất chỉ thị được cho vào bình tam giác. Dung dịch chuẩn NaOH 0,1M được cho vào burrete.
Phản ứng chuẩn độ: NaOH + HCl —> NaCl + H2O
Phenolphthalein là chất chỉ thị màu tồn tại ở dạng không màu trong khoảng pH từ 0 đến 8,3 và tồn tại ở dạng màu hồng trong pH từ 8,3 đến 10.
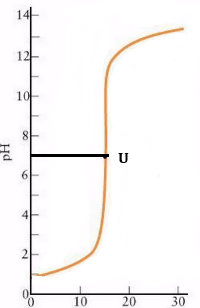
Điểm tương đương là điểm tại đó phản ứng chuẩn độ xảy ra vừa đủ. Đây là điểm mà ta mong muốn dừng lại nhưng không thể dừng được vì nó không có dấu hiệu gì cả (Lúc này dung dịch chỉ có NaCl, H2O nên pH = 7 và chất chỉ thị vẫn chưa đổi màu).
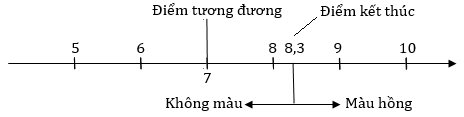
Khi chuẩn độ buộc phải dùng dư dung dịch NaOH và chấp nhận sai số do chất chỉ thị này. Sai số nhỏ nhất khi lượng NaOH dư làm cho dung dịch đạt tới pH = 8,3 để chất chỉ thị đổi màu và ta có dấu hiệu để dừng lại. Điểm pH = 8,3 chính là điểm kết thúc. Đây là điểm kết thúc mong muốn, còn có đạt được hay không phụ thuộc độ khéo léo của người làm.
Với cách chuẩn độ như trên (HCl + chỉ thị ở bình tam giác và NaOH ở burrete), pH tăng dần và vượt qua điểm tương đương (pH = 7) và tới điểm kết thúc (pH = 8,3), dấu hiệu kết thúc là dung dịch từ không màu chuyển qua màu hồng bền.
Nếu làm ngược lại (NaOH + chỉ thị ở bình tam giác và HCl ở burrete), pH sẽ giảm dần và tới ngay điểm kết thúc (pH = 8,3) mà chưa đi qua điểm tương đương, dấu hiệu kết thúc là dung dịch từ màu hồng chuyển qua không màu. Tuy nhiên mắt người nhạy với (không màu → hồng) hơn là (hồng → không màu), vì vậy làm ngược lại như này không sai về nguyên tắc nhưng tăng sai số do mắt người làm nhận định sai thời điểm.
Khoảng cách từ 7 đến 8,3 là sai số do chất chỉ thị và có thể giảm sai số này bằng cách đổi chất chỉ thị khác có điểm đổi màu gần với pH = 7 hơn hoặc loại bỏ hoàn toàn sai số này nếu dùng máy đo pH thay cho chất chỉ thị. pH = 7 thì máy báo và ta dừng lại.
Điều gì đã diễn ra trong quá trình chuẩn độ?
Những giọt NaOH đầu tiên rơi xuống thì lượng HCl trong bình tam giác đang nhiều áp đảo hoàn toàn nên ta không quan sát thấy màu sắc gì cả. Một thời gian sau, khi HCl đã giảm xuống và không còn áp đảo so với lượng NaOH, các vệt màu hồng sẽ xuất hiện nhưng nhanh chóng biến mất. Nguyên nhân là do NaOH rơi xuống nhưng HCl còn ít nên không thể trung hòa ngay lập tức, và trong khoảnh khắc khu vực nào có NaOH dư thì màu hồng xuất hiện… càng về cuối thời gian sống của màu hồng này càng lâu và vệt màu hồng càng rộng:
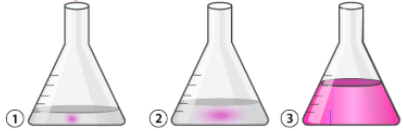
Tới khi màu hồng xuất hiện trong toàn bộ bình tam giác và ta lắc đều trong khoảng 10s ta được màu hồng bền và đã tới điểm kết thúc. Vấn đề này có bài ghi 10s, có bài ghi 20s đều đúng cả. 10s hay 20s là thời gian ta lắc và quan sát chứ không phải thời gian sống của màu hồng. Nếu lắc trong 10s mà màu hồng lại biến mất thì chuẩn độ vẫn còn non, cần nhỏ thêm 1 giọt NaOH từ burrete và lắc tiếp. Sau thời gian này, 2 phút hay 5 phút sau màu hồng vẫn còn đó chứ không biến mất (vì lúc này bình tam giác chứa dung dịch NaOH rồi, phải để thật lâu màu hồng mới nhạt đi do NaOH tương tác với CO2 trong không khí và chuyển hóa thành chất kiềm yếu hơn như Na2CO3, NaHCO3)
Điểm kết thúc (pH = 8,3) cách khá xa điểm tương đương (pH = 7) thì sai số lớn tới mức nào?
Ta lấy số liệu cụ thể để kiểm tra sai số: Nồng độ HCl, NaOH đều là 0,1M
Trước khi chuẩn độ, dung dịch HCl có pH = -lg(0,1) = 1
Coi thể tích thay đổi không đáng kể:
Khi HCl đã hết 99,9%, chỉ còn lại 0,1%: pH = -lg(0,1.0,1%) = 4
Khi HCl hết và NaOH đã dư 0,1%: pH = 14 + lg(0,1.0,1%) = 10
Nhận xét: Từ lúc bắt đầu chuẩn độ đến khi 99,9% HCl đã hết thì pH thay đổi rất chậm (tăng từ 1 lên 4), nhưng từ lúc 0,1% HCl còn lại bị trung hòa đến khi NaOH dư 0,1% thì pH có bước tăng nhảy vọt từ 4 lên 10, tức là tại điểm kết thúc (pH = 8,3) thì lượng NaOH dư nhỏ hơn 0,1%, đây là một số dư rất nhỏ và chấp nhận được.
Đồ thị sự phụ thuộc pH vào lượng NaOH 0,1M, thêm vào dung dịch HCl 0,1M với U là điểm uốn của đồ thị, cũng chính là điểm tương đương: