Aspirin (acetylsalicylic acid) là thuốc hạ sốt, giảm đau, có tính kháng viêm, được sử dụng phổ biến trên thế giới. Quy trình tổng hợp Aspirin (acetylsalicylic acid) theo các bước sau:
Bước 1: Cân chính xác 5 gam salicylic acid cho vào bình nón có dung tích 250 mL, tiếp theo đong lấy 8 L anhydride acetic (D = 1,08 g/mL) cho vào bình.
Bước 2: Thêm 0,4 mL sulfuric acid đặc vào hỗn hợp và trộn đều.
Bước 3: Đun nóng hỗn hợp trong bình nón ở khoảng 10 – 15 phút, duy trì nhiệt độ khoảng 70°C để phản ứng xảy ra.
Bước 4: Lấy hỗn hợp sau phản ứng, để nguội tự nhiên và khuấy đều. Sau đó, thêm 150 mL nước để thúc đẩy quá trình kết tinh aspirin. Dùng phễu Buchner để lọc kết tinh aspirin và rửa sạch với nước lạnh. Sấy khô aspirin ở nhiệt độ 60°C thu được 3,8 gam aspirin tinh khiết.
1. Thực hiện các yêu cầu sau:
a. Viết phản ứng tổng hợp aspirin
b. Nêu vai trò của sulfuric acid đặc. Nếu thay sulfuric acid đặc bằng phosphoric acid hoặc acetic acid thì hiệu suất phản ứng tổng hợp aspirin thay đổi như thế nào?
d. Tính hiệu suất của phản ứng tổng hợp aspirin.
2. Để sản xuất 2700000 viên nén uống (hàm lượng aspirin 500 mg/viên) cần tối thiểu m tấn salicylic acid với hiệu suất phản ứng tính theo salicylic acid là 60%.
3. Khi uống aspirin, phản ứng thủy phân trong môi trường acid tạo ra salicylic acid là thành phần chính có tác dụng hạ sốt, giảm đau và viêm nhiễm, nên có nhiều nghiên cứu tập trung vào phản ứng thủy phân này và các yếu tố ảnh hưởng đến tốc độ phản ứng. Dữ liệu về quá trình thủy phân của một mẫu aspirin trong nước (môi trường trung tính) ở 37°C thể hiện trong bảng:
Thời gian (giờ)…………….. 0…… 20……. 40……. 50……. 100
C aspirin (×10^-3 M)…. 5,55… 5,15….. 4,78…. 4,61…… 3,83
a. Tính nồng của salicylic acid sau thời gian 20, 40, 50, 100 giờ.
b. Tính tốc độ trung bình của phản ứng thủy phân aspirin sau thời gian 20, 40, 50, 100 giờ.
c. Nhận xét sự thay đổi tốc độ phản ứng theo thời gian. Giải thích.
Câu trả lời tốt nhất
1. (a) 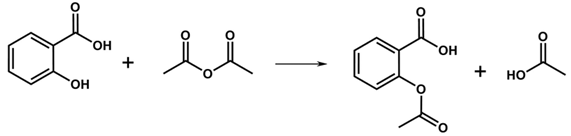
(b) Đây là phản ứng 1 chiều, tuy nhiên vẫn cần hạn chế sự có mặt của H2O vì H2O sẽ làm anhydride acetic chuyển hóa thành acetic acid. Acetic acid là tác nhân acetyl hóa kém hơn anhydride acetic nên phản ứng sẽ không xảy ra. Có thể dùng H2SO4 đặc, H3PO4 đặc để xúc tác cho phản ứng này. Dùng CH3COOH thì hiệu suất sẽ thấp.
(c) nHOC6H4COOH = 5/138 = 0,03623
n(CH3CO)2O = 8.1,08/102 = 0,08471
nAspirin = 3,8/180 = 0,02111
—> H = 0,02111/0,03623 = 58,27%
2.
m aspirin = 2700000.500 = 1350000000 mg = 1,35 tấn
—> mHOC6H4COOH = 1,35.138/(180.60%) = 1,725 tấn
3.
(a)(b)
Nồng độ của salicylic acid và tốc độ trung bình của phản ứng:
20h: 5,55 – 5,15 = 0,4 mmol/L —> v = 0,4/20 = 0,02 mmol/L.giờ
40h: 5,55 – 4,78 = 0,77 mmol/L —> v = 0,77/40 = 0,01925 mmol/L.giờ
50h: 5,55 – 4,61 = 0,94 mmol/L —> v = 0,94/50 = 0,0188 mmol/L.giờ
100h: 5,55 – 3,83 = 1,72 mmol/L —> v = 1,72/100 = 0,01722 mmol/L.giờ
(c) Tốc độ phản ứng thủy phân chậm dần theo thời gian do nồng độ aspirin giảm dần theo thời gian.

