Điện phân 400 ml dung dịch gồm NaCl, HCl và CuSO4 0,02M với điện cực trơ và màng ngăn xốp. Cường độ dòng điện là 1,93 ampe. Coi thể tích dung dịch không thay đổi trong quá trình điện phân. Chỉ số pH theo thời gian được biểu diễn bằng đồ thị sau đây
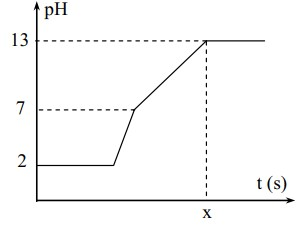
Biết hằng số Faraday = 96500. Giá trị của x trong hình vẽ là:
A. 1800. B. 3600. C. 1200. D. 3000.
Câu trả lời tốt nhất
Ban đầu: pH = 2 —> [H+] = 0,01 —> nHCl = 0,004
Đoạn 1: pH không thay đổi trong khoảng thời gian catot khử Cu2+ và anot oxi hóa Cl-.
ne đoạn 1 = 2nCu2+ = 0,016
Đoạn 2: pH tăng nhanh chóng do H+ bị khử cho tới khi hết tại catot.
ne đoạn 2 = nH+ = 0,004
Đoạn 3: pH tiếp tục tăng, dung dịch chuyển sang môi trường kiềm do H2O bị khử tại catot tạo OH-:
pH = 13 —> [OH-] = 0,1 —> nOH- = 0,04
2H2O + 2e —> 2OH- + H2
—> ne đoạn 3 = nOH- = 0,04
ne tổng 3 đoạn = 0,06 = It/F
—> t = 3000
Dạ cho em hỏi là tại sao chỉ có H20 ở catot bị điện phân ra OH- khi đó pH=13, mà không phải là do H20 ở mỗi bên đều bị điện phân rồi sau khi phản ứng trung hoà xảy ra hết thì còn dư lại OH- ạ?
