Điện phân dung dịch CuSO4 và NaCl với điện cực trơ, cường độ dòng điện không đổi 2A, hiệu suất 100%. Kết quả thí nghiệm được ghi ở bảng sau:
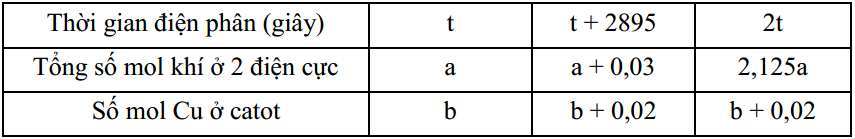
Nếu dừng điện phân ở thời điểm 5404 giây rồi cho thanh sắt dư vào dung dịch, sau khi phản ứng xảy ra hoàn toàn, khối lượng thanh sắt thay đổi như thế nào?
A. Tăng 0,032 gam. B. Giảm 0,256 gam.
C. Giảm 0,560 gam. D. Giảm 0,304 gam.
Câu trả lời tốt nhất
Trong khoảng thời gian 2895 (s) (trao đổi 0,06 mol electron) thì tại cực âm thoát ra 0,02 mol Cu và 0,01 mol H2
—> 0,02 mol khí còn lại gồm Cl2 (x mol) và O2 (y mol)
—> x + y = 0,02 và 2x + 4y = 0,06
—> x = y = 0,01
Trong khoảng thời gian từ t + 2895 —> 2t chỉ là điện phân H2O nên phần khí tăng thêm là 2,125a – a – 0,03 = 1,125a – 0,03 chỉ bao gồm O2 và H2. Do nH2 = 2nO2 nên:
nO2 = 0,375a – 0,01
nH2 = 0,75a – 0,02
Như vậy trong thời gian từ t —> 2t thì tại cực dương có:
nCl2 = 0,01
nO2 = 0,375a – 0,01 + y = 0,375a
Bảo toàn electron cho cực dương ở 2 khoảng thời gian (0 —> t) và (t —> 2t)
2a = 0,01.2 + 0,375a.4 —> a = 0,04
Ban đầu: nCuSO4 = a + 0,02 = 0,06 và nNaCl = 2a + 2x = 0,1
Khi t = 5404 thì ne = 0,112
Catot: nCu = 0,056 —> nCu2+ dư = 0,004
Anot: ne > nCl- nên Cl- đã hết, có O2 thoát ra
Dung dịch điện phân lúc này chứa Cu2+ (0,004), SO42- (0,06), Na+ (0,1), bảo toàn điện tích —> nH+ = 0,012
Bảo toàn electron: 2nFe phản ứng = 2nCu2+ + nH+
—> nFe phản ứng = 0,01
Δm = mCu – mFe phản ứng = -0,304
—> Giảm 0,304 gam
