Hòa tan hoàn toàn 7,26 gam hỗn hợp gồm Al và Al2O3 trong dung dịch chứa a mol H2SO4, thu được 2,688 lít khí H2 (đktc) và dung dịch X. Cho từ từ dung dịch Ba(OH)2 đến dư vào X, sự phụ thuộc Số mol kết tủa với số mol Ba(OH)2 được biểu thị theo đồ thị sau:
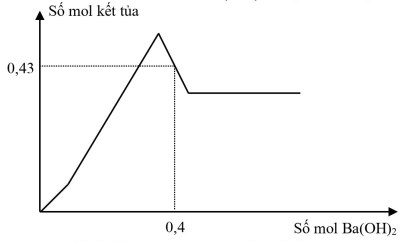
Giá trị của a là
A. 0,37. B. 0,35. C. 0,36. D. 0,38.
Câu trả lời tốt nhất
nH2 = 0,12 —> nAl = 0,08
—> nAl2O3 = 0,05
Bảo toàn Al —> nAl3+ = 0,18
Dung dịch X chứa Al3+ (0,18), SO42- (a) và H+ dư (b)
Bảo toàn điện tích —> 2a = b + 0,18.3 (1)
0,43 mol kết tủa gồm BaSO4 (a) và Al(OH)3 (0,43 – a), lúc này kết tủa đã bị hòa tan một phần nên:
nOH- = 0,4.2 = b + 0,18.4 – (0,43 – a) (2)
(1)(2) —> a = 0,35; b = 0,16
anh ơi chỗ đó sao mình biết so42- đủ để đưa hết lên al+3 vậy ạ
Thầy ơi cho em hỏi chỗ đoạn gấp khúc nhỏ nhỏ đầu tiên là lúc bắt đầu xuất hiện thêm Al(OH)3 đúng k ạ
cho mk hỏi là sao H+ dư vậy, theo đồ thị thì cho Ba(OH)2 vào là xuất hiện kết tủa luôn mà

