Hòa tan hoàn toàn 9,15 gam hỗn hợp X gồm Al và Al2O3 trong 400 ml dung dịch H2SO4 1M thu được dung dịch y và 5,04 lít H2 đktc.
a. Xác định phần trăm khối lượng mỗi chất trong X.
b. Cho từ từ dung dịch KOH 2M vào dung dịch Y kết quả thí nghiệm được biểu diễn theo đồ thị dưới đây.
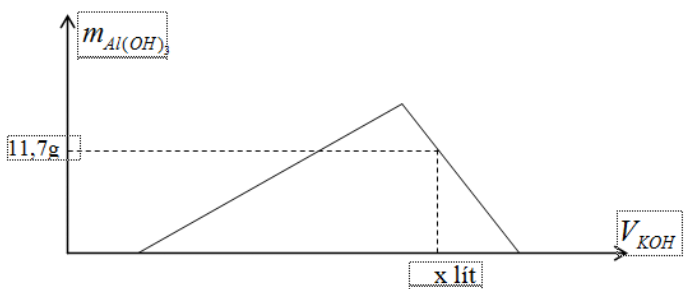
Dựa vào đồ thị hãy xác định giá trị của x.
Câu trả lời tốt nhất
nH2 = 0,225 —> nAl = 0,15
mX = 9,15 —> nAl2O3 = 0,05
—> %Al = 44,26% và %Al2O3 = 55,74%
Bảo toàn Al —> nAl3+ = 0,25
Y chứa Al3+ (0,25), SO42- (0,4), bảo toàn điện tích —> nH+ dư = 0,05
Dựa vào đồ thị ta thấy Al(OH)3 đã bị hòa tan một phần và còn lại nAl(OH)3 = 0,15
nOH- = nH+ + 4nAl3+ – nAl(OH)3 = 0,9
—> x = 0,45 lít
Thầy ơi em tưởng so42- trong y là 0,125 chứ ạ nó phản ứng vào al với al2o3 mất 0,375 rồi mà ạ
H2SO4 + 2KOH —-> (1)
Al2(SO4)3 + 6KOH —-> (2)
Al(OH)3 + KOH —-> (3)
nKOH (1) = 0,25
nAl2(SO4)3 = 0,125 -> nAl(OH)3 (max)= 0,25
-> nAl(OH)3 (3) = 0,25-0,15=0,1
-> nKOH (3) = 0,1 mol
nKOH (2) = 6nAl2(SO4)3 = 0,75
-> nKOH (phản ứng) = 0,25 +0,75+0,1=1,1 mol
Thầy giúp em xem sai chỗ nào ạ. Em cảm ơn!
