Hòa tan hoàn toàn m gam Al vào 1 lit dung dịch hỗn hợp chứa a mol HCl và b mol H2SO4 loãng, sau phản ứng thu được dung dịch X và V lít khí H2 ở điều kiện tiêu chuẩn. Thêm từ từ tới dư dung dịch Ba(OH)2 1M vào dung dịch X cho tời khi các phản ứng xảy ra hoàn toàn. Kết quả thí nghiệm được biểu diễn trên đồ thị
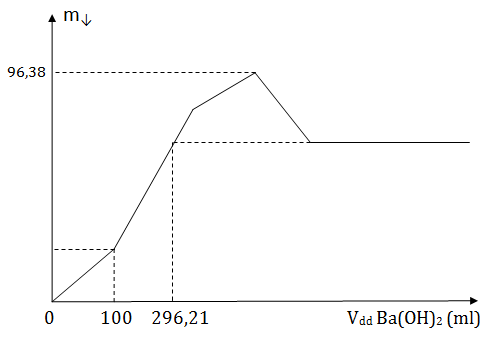
Giá trị của m, a, b là?
Câu trả lời tốt nhất
Đặt nAl = c
Quan sát đồ thị ta thấy có 5 đoạn. Tính từ gốc tọa độ:
Đoạn 1: Ba(OH)2 trung hòa H2SO4 dư
—> nH2SO4 dư = 0,1
Bảo toàn điện tích: 3c = a + 2(b – 0,1) (1)
Đoạn 2: Ba(OH)2 tác dụng với Al2(SO4)3
Đoạn 3: Ba(OH)2 tác dụng với AlCl3
m↓ max = 233b + 78c = 96,38 (2)
Đoạn 4: Ba(OH)2 hòa tan hết Al(OH)3
Kết thúc đoạn 4 thì m↓ = mBaSO4 = 233b
Đoạn 5: Không còn phản ứng gì
Quay lại đoạn 2, ta xét điểm có hoành độ 296,21 và tung độ 233b.
nBa(OH)2 = 0,29621 mol —> nBaSO4 = 0,29621
nAl(OH)3 = (0,29621.2 – 0,1.2)/3 = 0,13081
Vậy 233b = 0,29621.233 + 0,13081.78
—> b = 0,34
Kết hợp (1)(2) —> a = 0,18 và c = 0,22
—> mAl = 5,94
ad cho em hỏi cái chỗ bảo toàn điện tích 3c=a+2(b-0.1) là sao ạ
Tại sao những bài khác đa số đều dùng ion mà bài này mình lại dùng phân tử vậy ạ ?
cho em hỏi là sao mình biết được là khối lượng kết tủa max là 78c+233b ạ, lỡ trường hợp khi tạo ra được b mol baso4 thì phần al(oh)3 đã bị oh- hòa tan một phần rồi hoặc trường hợp khi được c mol al(oh)3 thì lại chưa tạo ra đủ b mol baso4 thì sao ạ
Em thưa thầy em nghĩ là ở đoạn 2 vừa tạo thành kết tủa BaSO4 và Al(OH)3 , còn ở đoạn 3 thì Al(OH)3 bắt đầu tan ra còn BaSO4 vẫn đc sinh ra đến đoạn đỉnh thì BaSO4 max ạ , e suy luận thế sai chỗ nào ạ
Đoạn 2, 3 phản ứng của Ba(OH)2 với Al2(SO4)3 và Ba(OH)2 với AlCl3 hai phản ứng này xảy ra đồng thời sao lại tách ra vậy admin?

