Hòa tan hoàn toàn m gam Al vào 1 lit dung dịch hỗn hợp chứa a mol HCl và b mol H2SO4 loãng, sau phản ứng thu được dung dịch X và V lít khí H2 ở điều kiện tiêu chuẩn. Thêm từ từ tới dư dung dịch Ba(OH)2 1M vào dung dịch X cho tời khi các phản ứng xảy ra hoàn toàn. Kết quả thí nghiệm được biểu diễn trên đồ thị
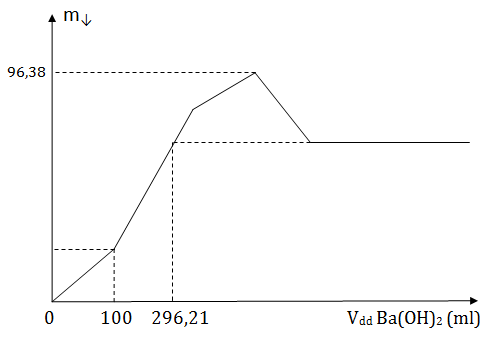
Giá trị của m, a, b là?
Câu trả lời tốt nhất
Đặt nAl = c
Quan sát đồ thị ta thấy có 5 đoạn. Tính từ gốc tọa độ:
Đoạn 1: Ba(OH)2 trung hòa H2SO4 dư
—> nH2SO4 dư = 0,1
Bảo toàn điện tích: 3c = a + 2(b – 0,1) (1)
Đoạn 2: Ba(OH)2 tác dụng với Al2(SO4)3
Đoạn 3: Ba(OH)2 tác dụng với AlCl3
m↓ max = 233b + 78c = 96,38 (2)
Đoạn 4: Ba(OH)2 hòa tan hết Al(OH)3
Kết thúc đoạn 4 thì m↓ = mBaSO4 = 233b
Đoạn 5: Không còn phản ứng gì
Quay lại đoạn 2, ta xét điểm có hoành độ 296,21 và tung độ 233b.
nBa(OH)2 = 0,29621 mol —> nBaSO4 = 0,29621
nAl(OH)3 = (0,29621.2 – 0,1.2)/3 = 0,13081
Vậy 233b = 0,29621.233 + 0,13081.78
—> b = 0,34
Kết hợp (1)(2) —> a = 0,18 và c = 0,22
—> mAl = 5,94
Đoạn 2, 3 phản ứng của Ba(OH)2 với Al2(SO4)3 và Ba(OH)2 với AlCl3 hai phản ứng này xảy ra đồng thời sao lại tách ra vậy admin?
ad cho em hỏi cái chỗ bảo toàn điện tích 3c=a+2(b-0.1) là sao ạ
Tại sao những bài khác đa số đều dùng ion mà bài này mình lại dùng phân tử vậy ạ ?
cho em hỏi là sao mình biết được là khối lượng kết tủa max là 78c+233b ạ, lỡ trường hợp khi tạo ra được b mol baso4 thì phần al(oh)3 đã bị oh- hòa tan một phần rồi hoặc trường hợp khi được c mol al(oh)3 thì lại chưa tạo ra đủ b mol baso4 thì sao ạ
Em thưa thầy em nghĩ là ở đoạn 2 vừa tạo thành kết tủa BaSO4 và Al(OH)3 , còn ở đoạn 3 thì Al(OH)3 bắt đầu tan ra còn BaSO4 vẫn đc sinh ra đến đoạn đỉnh thì BaSO4 max ạ , e suy luận thế sai chỗ nào ạ

