Hợp chất G tạo thành từ các ion X+ và Y2-. Ion X+ có 5 nguyên tử của hai nguyên tố và có 10 electron. Ion Y2- có 4 nguyên tử của 2 nguyên tố thuộc cùng một chu kỳ và cách nhau một ô trong bảng tuần hoàn. Tổng số electron trong Y2- là 32.
a) Xác định công thức của G.
b) Viết công thức Lewis của các ion X+ và Y2-.
c) Xác định kiểu lai hóa của nguyên tố trung tâm và dạng hình học của 2 ion X+ và Y2-.
Câu trả lời tốt nhất
(a)
Ion X+ có 10e —> 5 nguyên tử tạo ra X+ có tổng 11 proton —> Trung bình mỗi nguyên tử có 11/5 = 2,2 proton.
He không tạo ion —> X+ chứa H (có 1p)
X+ có dạng RHa+ —> ZR + a = 11
—> a = 4 và ZR = 7 là nghiệm phù hợp.
—> X+ là NH4+.
Ion Y2- có 32e —> 4 nguyên tử tạo ra Y2- có tổng 30 proton
—> Trung bình mỗi nguyên tử có 30/4 = 7,5 proton
Hai nguyên tố thuộc cùng một chu kỳ và cách nhau một ô trong bảng tuần hoàn —> Hơn kém nhau 2 hạt proton —> 7p và 9p hoặc 6p và 8p
Chọn cặp 6p (C) và 8p (O) vì có ion thỏa mãn là CO32-.
Vậy G là (NH4)2CO3
(b) Công thức Lewis của NH4+ và CO32-:
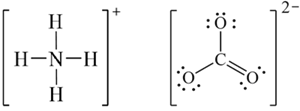
(c) Nguyên tử N trong NH4+ lai hóa sp3, phân tử NH4+ có dạng tứ diện đều, trong đó 4H ở 4 đỉnh và N ở tâm tứ diện.
Nguyên tử C trong CO32- lai hóa sp2, phân tử CO32- có dạng tam giác đều, trong đó 3O ở 3 đỉnh và C ở tâm tam giác.

