Lấy 233 mg hợp chất A (tạo bởi một kim loại nhóm IIA; C; O; H) được đưa đi phân tích bằng nhiệt; người ta đo sự thay đổi khối lượng theo nhiệt độ được kết quả:
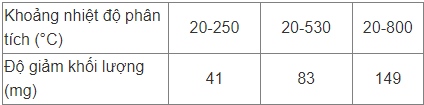
Chất rắn còn lại ở thí nghiệm cuối cùng là một oxide màu trắng của kim loại. Lấy 12 mg A được đem đi oxi hoá bằng oxygen dư ở 900°C; sản phẩm oxi hoá được hấp thụ bởi anhydrone (chất hút ẩm có công thức Mg(ClO4)2) và sau đó là NaOH (tẩm trong lưới xốp). Khối lượng chất bị hấp thụ bởi anhydrone là 2,09 mg; khối lượng bị hấp thụ bởi NaOH là 6,813 mg. Khối lượng chất rắn còn lại là 4,335mg.
a. Giải thích kết quả thí nghiệm trên.
b. Hãy xác định công thức chất A.
Câu trả lời tốt nhất
(a) A là một muối ngậm nước. Khi nung A, tùy mức nhiệt độ mà A có thể mất bớt H2O, mất hết nước và cuối cùng muối khan bị phân hủy thành oxide, vì vậy nhiệt độ càng cao thì khối lượng chất rắn giảm càng nhiều.
Mặt khác A bị oxi hóa bởi O2 nên A không phải muối của H2CO3, A là muối của acid hữu cơ.
(b) Anhydrone là chất hút ẩm —> mH2O = 2,09 mg (0,1161 mmol)
NaOH là chất hút CO2 —> mCO2 = 6,813 mg (0,1548 mmol)
Chất rắn còn lại là oxide RO (4,335)
Bảo toàn khối lượng —> nO2 = (2,09 + 6,813 + 4,335 – 12)/32 = 0,0387
Thành phần nguyên tố trong 12 mg A gồm:
nC = nCO2 = 0,1548
nH = 2nH2O = 0,2322
nR = nRO = 4,335/(R + 16)
nO = [12 – 0,1548.12 – 0,2322.1 – 4,335R/(R + 16)]/16 = [9,9102 – 4,335R/(R + 16)]/16
Bảo toàn electron: 4nC + nH + 2nR = 2nO + 4nO2
⇔ 0,1548.4 + 0,2322 + 2.4,335/(R + 16) = 2[9,9102 – 4,335R/(R + 16)]/16 + 0,0387.4
—> R = 40: R là Ca
Ca : C : H : O = 0,0774 : 0,1548 : 0,2322 : 0,4259
= 1 : 2 : 3 : 5,5 = 2 : 4 : 6 : 11
A là Ca2C4H6O11 hay 2Ca(COO)2.3H2O

