Một nhóm học sinh sau khi tìm hiểu về cách xác định giá trị hằng số Avogadro (NA) bằng phương pháp điện phân đã lập kế hoạch và thực hiện thí nghiệm như sau:
• Bước 1: Rửa sạch, làm khô hai điện cực bằng đồng. Cân điện cực anode và ghi lại giá trị m1.
• Bước 2: Cho V (mL) dung dịch H2SO4 1 M vào cốc thủy tinh sạch rồi gắn hai điện như hình minh họa.
• Bước 3: Tiến hành điện phân với cường độ dòng điện khoảng từ 0,1 đến 0,5 A trong thời gian 3 phút.
• Bước 4: Lấy điện cực anode ra, làm sạch, lau khô và cân lại, ghi lại giá trị m2.
Thí nghiệm 1: Nhóm học sinh thực hiện điện phân với cường độ dòng điện 0,2 A và quan sát thấy:
(1) Có một lượng nhỏ bọt khí được tạo ra trên anode và khối lượng anode giảm đi m gam.
(2) Ở cathode có một lượng lớn bong bóng khí được tạo ra.
(3) Dung dịch điện phân chuyển thành màu xanh.
Sau khi kiểm tra lại, nhóm học sinh biết được phản ứng sinh ra khí ở anode là một phản ứng phụ không mong muốn và sẽ làm ảnh hưởng đến giá trị NA tính được. Lúc này, nhóm học sinh đưa ra hai giả thuyết:
Giả thuyết 1: Cường độ dòng điện càng lớn thì càng dễ gây ra phản ứng phụ ở anode.
Giả thuyết 2: Nồng độ sulfuric acid càng thấp thì càng dễ gây ra phản ứng phụ ở anode.
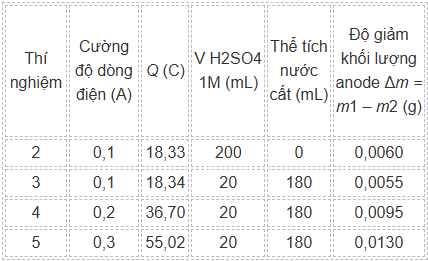
Để kiểm chứng hai giả thuyết này, nhóm học sinh tiếp tục tiến hành thí nghiệm theo các bước trên, sử dụng cảm biến để đo điện lượng Q (C) chạy qua mạch và tính độ giảm khối lượng anode. Các điều kiện khác là giống nhau. Kết quả thí nghiệm được thể hiện trong bảng dưới đây.
Biết:
– Giá trị hằng số Avogadro thực tế NA = 6,022.10²³.
– Giá trị hằng số Avogadro tính từ thí nghiệm điện phân theo công thức: NA = Q/(2nCu.qe) trong đó: Q (C) là điện lượng thực tế sử dụng trong quá trình điện phân; nCu (mol) là số mol Cu đã bị điện phân ở anode; qe là giá trị điện tích của một electron, qe = 1,6.10–19 C.
– Nguyên tử khối của Cu là 63,55.
a) Khí sinh ra ở anode trong thí nghiệm 1 là khí H2.
b) Giá trị của NA tính từ thí nghiệm 1 sẽ lớn hơn 6,022.10²³.
c) Từ kết quả thu được ở các thí nghiệm từ 2 đến 5, kết luận được giả thuyết 1 là sai, giả thuyết 2 là đúng.
d) Giá trị của NA tính từ một thí nghiệm tối ưu nhất (có sai số nhỏ nhất so với giá trị thực tế) trong số các thí nghiệm từ 2 đến 5 là 6,07.10²³ (kết quả đã được làm tròn đến hàng phần trăm).
Câu trả lời tốt nhất
(a) Sai, tại anode bằng Cu ngoài phản ứng chính là:
Cu —> Cu2+ + 2e
còn có phản ứng phụ: 2H2O —> O2 + 4H+ + 4e
Vậy lượng nhỏ khí thoát ra từ anode là O2.
(b) Đúng
Theo công thức NA = Q/(2nCu.qe)
Trong đó Q là điện lượng thực tế sử dụng, dành cho cả phản ứng chính (tạo Cu2+) và phản ứng phụ (tạo O2), như vậy tử số đã tăng lên phần tạo O2 nên NA tính được sẽ lớn hơn thực tế.
(c) Sai
Ta có: mCu tan ra = m anode giảm
Xét giả thuyết (1), căn cứ kết quả thí nghiệm 3, 4, 5 với nồng độ acid giữ nguyên và cường độ dòng điện tăng dần, ta thấy khối lượng Cu tan ra tăng lên nhưng không tỉ lệ thuận với cường độ dòng tăng lên (cường độ tăng gấp 2, rồi gấp 3 nhưng lượng Cu tan tăng với số lần ít hơn) —> Cường độ càng lớn thì O2 thoát ra càng nhiều —> Giả thuyết 1 là đúng.
Xét giả thuyết (2), căn cứ kết quả thí nghiệm 2, 3 với cường độ dòng điện không đổi, thí nghiệm 2 dùng acid với nồng độ cao hơn thí nghiệm 3 và kết quả là lượng Cu tan của thí nghiệm 2 cũng lớn hơn thí nghiệm 3 —> Nồng độ acid càng thấp thì càng dễ gây ra phản ứng phụ —> Giả thuyết 2 là đúng.
(d) Đúng
Hai giả thuyết đều đúng nên tính trong các thí nghiệm đã làm thì:
+ Cường độ càng nhỏ càng tốt.
+ Nồng độ H2SO4 càng cao càng tốt.
—> Các yếu tố tốt nhất hội tụ cho thí nghiệm 2, vậy ta sẽ sử dụng kết quả thí nghiệm này để tính NA:
NA = Q/(2nCu.qe)
Trong đó Q = 18,33; nCu = 0,006/63,55; qe = 1,6.10–19 —> NA = 6,07.10²³

