Nhỏ từ từ đến dư dung dịch H2SO4 vào dung dịch chứa đồng thời NaAlO2, Ba(AlO2)2, Ba(OH)2. Sự phụ thuộc khối lượng kết tủa (y gam) vào số mol H2SO4 tham gia phản ứng (x mol) được biểu diễn bằng đồ thị sau:
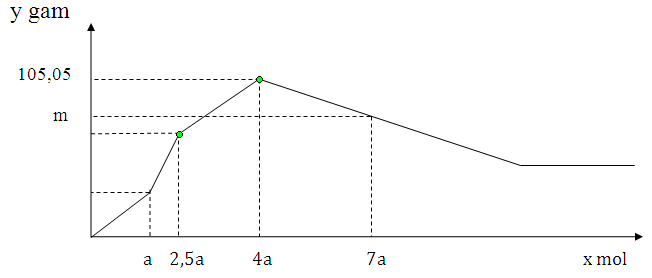
Giá trị m là
A. 89,45 B. 77,7 C. 93,35 D. 81,65
Câu trả lời tốt nhất
Đoạn 1: nH2SO4 đoạn này = a
Ba(OH)2 + H2SO4 —> BaSO4 + 2H2O
Đoạn 2: nH2SO4 đoạn này = 1,5a
Ba(AlO2)2 + H2SO4 + 2H2O —> BaSO4 + 2Al(OH)3
Đoạn 3: nH2SO4 đoạn này = 1,5a
2NaAlO2 + H2SO4 + 2H2O —> 2Al(OH)3 + Na2SO4
—> nBaSO4 = 2,5a và nAl(OH)3 = 6a
—> m↓ max = 2,5a.233 + 6a.78 = 105,05
—> a = 0,1
Khi nH2SO4 = 7a thì có nH2SO4 = 7a – 4a = 3a dùng để hòa tan Al(OH)3
—> nAl(OH)3 bị hòa tan = 2a = 0,2
—> nAl(OH)3 còn lại = 6a – 0,2 = 0,4
—> m = mBaSO4 + mAl(OH)3 còn lại = 89,45 gam
dạ cho e hỏi tại đoạn 7a bảo toàn điện tích thì mol Na+(0,45) SO42-(0,7-nSO4 trong BaSO4 kết tủa=0,45) bảo toàn điện tích thì mol AL3+ còn lại là 0,15 vậy suy ra mol AL(OH)3 theo bảo toàn nguyên tố AL là 0,45 vậy e đã sai ở đâu v ạ vì e tính được ở 7a mol al(oh)=0,45 cơ ạ
Cho em hỏi vì sao đoạn 2 không xảy ra đồng thời phản ứng của NaAlO2 + H2SO4 và Ba(AlO2)2 + H2SO4

