Nhỏ từ từ dung dịch Ba(OH)2 vào ống nghiệm chứa dung dịch H2SO4 và Al2(SO4)3. Đồ thị biểu diễn sự phụ thuộc khối lượng kết tủa theo số mol Ba(OH)2 như sau:
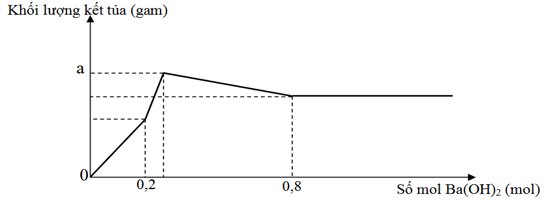
Khi lượng kết tủa là 159,25 gam thì số mol Ba(OH)2 đã dùng là
A. 0,65. B. 0,75. C. 0,85. D. 0,55.
Câu trả lời tốt nhất
Đoạn 1:
H+ + OH- —> H2O
Ba2+ + SO42- —> BaSO4
—> nH+ = 0,2.2 = 0,4
Đoạn 2:
Al3+ + 3OH- —> Al(OH)3
Ba2+ + SO42- —> BaSO4
Đoạn 3:
Al(OH)3 + OH- —> AlO2- + H2O
Khi kết thúc đoạn 3 thì: nOH- = nH+ + 4nAl3+
—> nAl3+ = 0,3
Vậy ban đầu: H+ (0,4), Al3+ (0,3), SO42- (0,65)
Trong 159,25 gam kết tủa chứa BaSO4 (x) và Al(OH)3 (y)
—> 233x + 78y = 159,25 (1)
TH1: Nếu cả 2 kết tủa đều chưa đạt cực đại:
—> 2x = 0,4 + 3y (2)
(1)(2) —> x = 0,5953 và y = 0,2635
TH2: Cả 2 kết tủa đều cực đại sau đó Al(OH)3 bị hòa tan một phần:
Khi đó nBaSO4 = 0,65 —> nAl(OH)3 = y = 0,1
—> nOH- = nH+ + 4nAl3+ – nAl(OH)3 = 1,5
—> nBa(OH)2 = 0,75

