Nước là chất điện li yếu: H2O ⇌ H+ + OH−
Tích số nồng độ các ion H+ và OH−trong nước nguyên chất ở mỗi nhiệt độ là một hằng sô, gọi là tích số ion của nước, kí hiệu Kw (Kw = [H+][OH−]). Độ acid và độ kiềm của dung dịch có thể được đánh giá bằng nồng độ H+ hoặc quy về một giá trị gọi là pH với quy ước như sau: pH = −lg[H+]. Hình bên biểu diễn sự thay đổi pH của nước tinh khiệt theo nhiệt độ:
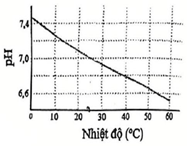
Cho các phát biểu sau:
(a) Nước tinh khiết có [H+] = [OH−].
(b) Quá trình điện li của nưởc là quá trình thu nhiệt.
(c) Ơ 25°C, nước tinh khiết có pH = 7.
(d) pH của nước tinh khiết giảm khi tăng nhiệt độ.
Số phát biểu đúng là
A. 3. B. 4. C. 1. D. 2.
Câu trả lời tốt nhất
(a) Đúng, theo như cân bằng phân ly của H2O thì [H+] = [OH−].
(b) Đúng, theo như đồ thị thì nhiệt độ tăng pH sẽ giảm (nồng độ H+ tăng) —> Tăng nhiệt độ cân bằng chuyển dịch theo chiều thuận nên chiều thuận thu nhiệt.
(c) Đúng, theo đồ thị, ở 25°C, nước tinh khiết có pH = 7.
(d) Đúng
