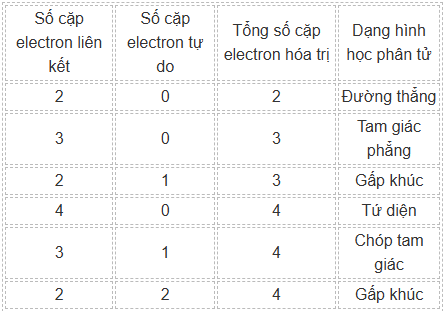
Thuyết VSEPR thường được sử dụng để dự đoán hình học phân tử, nhưng nó cũng có thể gián tiếp giải thích một số tính chất như độ phân cực, nhiệt độ sôi, hoặc khả năng tan trong nước, thông qua hình học phân tử. Thuyết VSEPR nhấn mạnh rằng hình học phân tử được quyết định bởi sự sắp xếp không gian của các cặp electron hóa trị (bao gồm cặp electron liên kết (mỗi liên kết được xem là “một cặp”) và cặp electron tự do) của nguyên tử trung tâm để giảm lực đẩy giữa chúng. Với một số trường hợp cơ bản như sau:
Để xem xét sự phân cực của phân tử, người ta dùng “một vector được vẽ trên liên kết, với đầu mũi tên chỉ về phía nguyên tử có độ âm điện cao hơn (từ phần mang điện tích dương δ+ sang điện tích âm δ-)”.
Cho hai phát biểu về 2 phân tử CO2 và SO2 (biết số hiệu nguyên tử ZC = 4; ZO = 8; ZS = 16):
(a) Phân tử CO2 có cấu trúc dạng đường thẳng và là một phân tử phân cực.
(b) Phân tử SO2 có cấu trúc dạng gấp khúc và là một phân tử phân cực.
Phát biểu đúng là:
A. Chỉ có (a).
B. Chỉ có (b).
C. Cả (a) và (b) đều đúng.
D. Cả (a) và (b) đều sai.
Câu trả lời tốt nhất
CO2 (O=C=O) nguyên tử trung tâm là C có 2 cặp electron liên kết, không có cặp electron tự do nào, tổng số cặp electron hóa trị là 2 —> Dạng đường thẳng. Vì là dạng đường thẳng nên mỗi liên kết C=O có phân cực về phía O nhưng toàn phân tử lại không phân cực —> (a) Sai.
SO2 (O=S→O) nguyên tử trung tâm là S có 2 cặp electron liên kết, 1 cặp electron tự do, tổng số cặp electron hóa trị là 3 —> Dạng gấp khúc. Các liên kết đều phân cực về phía O nên phân tử SO2 phân cực —> (b) Đúng.

