Trong một nhà máy sản xuất ammonia theo quy trình Haber, giai đoạn sản xuất khí hydrogen bằng phản ứng của methane và nước được thực hiện theo phương trình hóa học (1) như sau:
(1) CH4(g) + H2O(g) → CO(g) + 3H2(g)
Phản ứng (1) là phản ứng thu nhiệt mạnh. Lượng nhiệt này được cung cấp từ quá trình đốt cháy hoàn toàn khí methane theo phương trình hóa học (2):
(2) CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
Xét các phản ứng ở điều kiện chuẩn và hiệu suất chuyển hóa của methane là 100%. Tính khối lượng khí methane (theo tấn, làm tròn đến hàng phần trăm) cần thiết để sản xuất 0,30 tấn H2(g) trong giai đoạn trên. Biết 90% lượng nhiệt tỏa ra từ phản ứng (2) được cung cấp cho phản ứng (1) và các giá trị nhiệt tạo thành (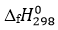 ) của các chất ở điều kiện chuẩn được cho trong bảng sau:
) của các chất ở điều kiện chuẩn được cho trong bảng sau:
Chất………………….. CH4(g)…… CO2(g)…… CO(g)…… H2O(g)
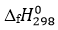 (kJ/mol)……. -74,6……. -393,5…… -110,5…… -241,8
(kJ/mol)……. -74,6……. -393,5…… -110,5…… -241,8
Câu trả lời tốt nhất
mCH4(1) = 0,3.16/(3.2) = 0,8 tấn
mCH4(2) = x tấn
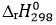 (1) = -110,5 – (-74,6 – 241,8) = 205,9 kJ
(1) = -110,5 – (-74,6 – 241,8) = 205,9 kJ
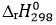 (2) = -393,5 – 241,8.2 – (-74,6) = -802,5 kJ
(2) = -393,5 – 241,8.2 – (-74,6) = -802,5 kJ
Bảo toàn năng lượng:
90%.802,5x.10^6/16 = 205,9.0,8.10^6/16
—> x = 0,23 tấn
—> mCH4 tổng = 0,8 + 0,23 = 1,03 tấn
