X và Y là 2 nguyên tố thuộc 2 nhóm A liên tiếp và 2 chu kỳ liên tiếp của bảng tuần hoàn (ZX < ZY). Tổng số hiệu nguyên tử của 2 nguyên tố là 25; X có phản ứng trực tiếp với Y ở điều kiện thường. Nguyên tố Z nằm cùng chu kỳ với Y. Tổng số electron độc thân trong 2 nguyên tử Y và Z ở trạng thái cơ bản là 4.
a) Xác định các nguyên tố X, Y, Z.
b) X, Y, Z tạo với hydrogen các hợp chất khí tương ứng là HxX; HyY; HzZ.
– Viết công thức Lewis và xác định dạng hình học của các phân tử dựa vào mô hình VSEPR.
– So sánh nhiệt độ sôi của các hợp chất và giải thích.
c) Nguyên tố T thuộc cùng chu kỳ với Y. Tổng số oxi hóa cao nhất và 3 lần số oxi hóa thấp nhất của T bằng 4. Viết công thức cấu tạo các acid có oxygen của T và so sánh tính acid của chúng, giải thích.
Câu trả lời tốt nhất
(a) ZX + ZY = 25 nên X và Y đều thuộc chu kỳ nhỏ.
Nếu ZX + 9 = ZY —> ZX = 8; ZY = 17 —> X là O, Y là Cl: Loại nghiệm này do O2 không phản ứng với Cl2.
Nếu ZX + 7 = ZY —> ZX = 9; ZY = 16 —> X là F, Y là S: Thỏa mãn do S có phản ứng với F2 ở điều kiện thường.
S có 2 electron độc thân —> Z có 4 – 2 = 2 electron độc thân —> Z là Si
(b) X, Y, Z tạo với hydrogen các hợp chất khí tương ứng là HF; H2S; SiH4.
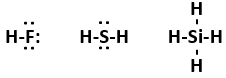
Phân tử HF chỉ có 2 nguyên tử nên có dạng đường thẳng.
Phân tử H2S có 2 nguyên tử H liên kết với nguyên tử trung tâm S và S còn 2 đôi electron hóa trị chưa tham gia liên kết nên theo mô hình VSEPR có dạng AX2E2 (phân tử dạng góc).
Phân tử SiH4 có 4 nguyên tử H liên kết với nguyên tử trung tâm Si và Si không còn đôi electron hóa trị chưa tham gia liên kết nào nên theo mô hình VSEPR có dạng AX4 (phân tử dạng tứ diện đều).
Nhiệt độ sôi: HF > H2S > SiH4
+ HF có liên kết hydrogen liên phân tử nên nhiệt độ sôi cao vượt trội so với H2S, SiH4
+ Liên kết H-S phân cực hơn liên kết H-Si nên lực Van der Waals giữa các phân tử H2S bền vững hơn giữa các phân tử SiH4, do đó H2S có nhiệt độ sôi cao hơn SiH4.
(c) T thuộc nhóm n có số oxi hóa cao nhất là +n, thấp nhất là n – 8
—> n + 3(n – 8) = 4 —> n = 7 —> T là Cl
Cấu tạo các acid HClO, HClO2, HClO3, HClO4:
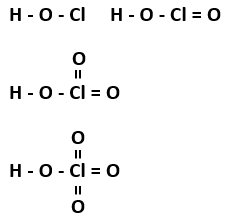
Tính acid tăng dần theo dãy HClO, HClO2, HClO3, HClO4: Khi số nguyên tử O tăng lên thì lực hút giữa H+ và gốc acid càng bị chia sẻ cho nhiều O nên càng kém bền, do đó tính acid tăng.
