Năng lượng của electron trong hệ gồm 1 electron và 1 hạt nhân (như H, He+, …) theo mô hình Rutherford – Bohr cũng như mô hình hiện đại đều phụ thuộc vào số thứ tự của lớp (n) và điện tích hạt nhân (Z) như sau:
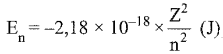
trong đó Z là điện tích hạt nhân; n = 1, 2, 3, … là số thứ tự của lớp electron. Hãy tính và so sánh (có giải thích) năng lượng của electron lớp thứ nhất của H, He+, Li2+.
Câu trả lời tốt nhất
H có Z = 1 —> E1 của H = -2,18.10^-18
He+ có Z = 2 —> E1 của He+ = -8,72.10^-18
Li2+ có Z = 3 —> E1 của Li2+ = -1,962.10^-17
Vậy E1 của H > H2+ > Li2+, nguyên nhân là do điện tích hạt nhân tăng dần thì lực hút giữa hạt nhân và electron cũng tăng, dẫn đến electron càng gần hạt nhân hơn và có năng lượng nhỏ hơn.
×
