Trinitroglycerol (TNG) đã được Alfred Nobel sử dụng làm chất nổ thương mại, là hợp chất nguy hiểm. TNG được sản xuất từ glycerol theo sơ đồ sau:
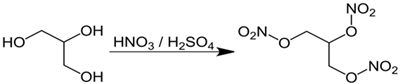
Câu 1. Nguyên liệu glycerol dùng sản xuất thuốc nổ là sản phẩm thủy phân hoàn toàn một loại chất béo đã tinh chế (A) có chứa tỉ lệ về số mol gồm 30% tristearin, 40% tripalmitin và 30% triolein. Để sản xuất ra 10 tấn thuốc nổ cần dùng m tấn chất béo (A). Biết trong thuốc nổ đó chứa 90,8% TNG , còn lại là tạp chất trơ, hiệu suất toàn bộ quá trình sản xuất là 80%. Giá trị của m là bao nhiêu? (kết quả làm tròn đến hàng phần mười).
Câu 2. Khi nổ, TNG phân hủy theo sơ đồ: C3H5(ONO2)3(s) → CO2(g) + H2O(g) + N2(g) + O2(g) (2)
a) Cho giá trị enthalpy chuẩn (kJ/mol) của các chất C3H5(ONO2)3(s), CO2(g) và H2O(g) lần lượt là -370,15; -393,5 và -241,8. Nhiệt lượng tỏa ra khi phân hủy hoàn toàn 227 kg TNG là 5659600 kJ.
b) TNG chứa ba liên kết π trong phân tử.
c) Nếu glycerol phản ứng với nitric acid theo tỉ lệ mol tương ứng 1 : 2 thì thu được tối đa hai đồng phân cấu tạo có cùng công thức phân tử C3H6O7N2.
d) Trong phản ứng (1) có sự thay thế các nguyên tử hydrogen của -OH bằng nhóm -NO2.
Câu trả lời tốt nhất
Câu 1.
10 tấn thuốc nổ chứa 9,08 tấn TNG
nC3H5(OH)3 phản ứng = nTNG = 10.90,8%/227 = 0,04 (triệu mol)
A chứa (C17H35COO)3C3H5 (3x mol), (C15H31COO)3C3H5 (4x mol), (C17H33COO)3C3H5 (3x mol)
—> 3x + 4x + 3x = 0,04 —> x = 0,004
mA = (890.3x + 806.4x + 884.3x)/80% = 42,7 tấn
Câu 2.
(a) Sai
4C3H5(ONO2)3(s) → 12CO2(g) + 10H2O(g) + 6N2(g) + O2(g) (2)
 (2) = -393,5.12 – 241,8.10 – (-370,15).4 = -5659,4 kJ
(2) = -393,5.12 – 241,8.10 – (-370,15).4 = -5659,4 kJ
Tỉ lệ: 227.4 gam C3H5(ONO2)3(s) phân hủy tỏa ra 5659,4 kJ nhiệt
—> 227000 gam C3H5(ONO2)3(s) phân hủy tỏa ra 1414850 kJ nhiệt
(b) Đúng, TNG chứa ba liên kết π trong phân tử (nằm trong 3N=O).
(c) Đúng, 2 đồng phân C3H6O7N2 là:
CH2-O-NO2
|
CHOH
|
CH2-O-NO2
CH2-O-NO2
|
CH-O-NO2
|
CH2OH
(d) Sai, trong phản ứng (1) thì -ONO2 thay thế -OH.
anh ơi cho em hỏi câu2 a) tính enthalpy thì em rút gọn sao cho hệ số cân bằng của TNG thành 1 thì tính được không ạ ? và tính như thế nào ạ?

