Trong phản ứng acetone với HCN xảy ra theo phản ứng sau:
(CH3)2C=O + HCN → (CH3)2C(OH)CN (∗)
Giai đoạn đầu tiên và quyết định tốc độ chung của phản ứng là
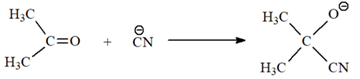
Phát biểu nào sau đây không đúng?
A. Khi thay acetone bằng acetaldehyde, tốc độ phản ứng không đổi.
B. Khi cố định pH của dung dịch, phản ứng (∗) có bậc hai.
C. Phản ứng (∗) thuộc loại phản ứng cộng nucleophile.
D. Khi thay HCN bằng KCN, tốc độ phản ứng xảy ra nhanh hơn.
Câu trả lời tốt nhất
A. Sai, acetaldehyde phản ứng với HCN nhanh hơn acetone do acetone có 2 gốc -CH3 đẩy electron làm tăng mật độ điện âm trên C của C=O khiến giai đoạn đầu không thuận lợi, 2 gốc -CH3 cũng gây cản trở không gian. Trái lại, acetaldehyde (CH3CHO) chỉ có 1 gốc -CH3 khiến các yếu tố bất lợi trên bị giảm sút.
B. Đúng, giai đoạn đầu quyết định tốc độ phản ứng có bậc II nên toàn bộ phản ứng có bậc II. Khi pH thay đổi:
+ Nếu pH quá thấp, CN- bị proton hóa (tạo HCN), không có CN- với lượng phù hợp, phản ứng sẽ không xảy ra.
+ Nếu pH quá cao, có rất nhiều CN- trong dung dịch khiến nồng độ của nó gần như không thay đổi, (*) trở thành bậc I, chỉ còn phụ thuộc nồng độ acetone.
C. Đúng, đây là phản ứng cộng nucleophile với tác nhân nucleophile là CN-.
D. Sai, nếu thay HCN bằng KCN thì đúng là giai đoạn đầu xảy ra nhanh hơn, nhưng giai đoạn 2 cần có H+ để trung hòa anion sản phẩm giai đoạn 1 ở trên. KCN lại làm điều ngược lại, nó không cung cấp được H+ mà lại thủy phân ra OH-, trong khi ion K+ lại không thể thay thế H+ do tạo sản phẩm kém bền.
Để phản ứng nhanh hơn và thuận tiện, cần nhiều CN- nhưng vẫn cần H+, có thể dùng hỗn hợp HCN và KCN hoặc KCN kèm theo 1 acid khác, đủ đảm bảo nguồn H+.

