Khi học về tốc độ phản ứng hóa học, một nhóm học sinh đã đưa ra giả thiết sau: “Tốc độ phản ứng tỉ lệ thuận với nồng độ (mol/L) của các chất (ion) tham gia phản ứng với số mũ là hệ số tỉ lượng của các chất (ion) đó trong phương trình hóa học”. Để kiểm định giả thiết đó học sinh làm thí nghiệm đo tốc độ phản ứng: 3I-(aq) + S2O82-(aq) → I3-(aq) + 2SO42-(aq) với kết quả ghi ở bảng sau:
Nồng độ I-(M)…. Nồng độ S2O82-(M)….. Tốc độ (tương đối)
0,001…………………… 0,001………………… 1
0,002…………………… 0,001………………… 2
0,002…………………… 0,002………………… 4
a) Khi tăng nồng độ chất tham gia phản ứng, tốc độ phản ứng giảm đi.
b) Trong biểu thức tính tốc độ tức thời 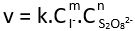 , k là hằng số tốc độ phụ thuộc vào nhiệt độ và bản chất phản ứng.
, k là hằng số tốc độ phụ thuộc vào nhiệt độ và bản chất phản ứng.
c) Hằng số tốc độ k càng lớn thì ảnh hưởng của nhiệt độ đến phản ứng càng lớn.
d) Với kết quả thí nghiệm trên, nhận định ban đầu của nhóm học sinh là đúng.
Câu trả lời tốt nhất
(a) Sai, khi tăng nồng độ chất tham gia phản ứng, tốc độ phản ứng tăng lên.
(b) Đúng
(c) Sai, nhiệt độ không ảnh hưởng trực tiếp đến tốc độ phản ứng mà nhiệt độ ảnh hưởng gián tiếp đến tốc độ phản ứng thông qua năng lượng hoạt hóa Ea. Nếu Ea rất nhỏ, việc tăng hay giảm nhiệt độ làm tốc độ phản ứng thay đổi rất ít. Nếu Ea lớn, việc tăng nhiệt độ có thể khiến tốc độ phản ứng tăng đột biến.
(d) Sai, nhận định của nhóm học sinh là không đúng, ví dụ nồng độ I- tăng gấp đôi (0,001 lên 0,002), nồng độ S2O82- không đổi, nếu theo nhận định này thì tốc độ phản ứng phải tăng tới 2³ = 8 lần, nhưng thực tế chỉ tăng có 2 lần.
( đã chỉnh sửa )
Câu c. Phân tích giả thiết đề bài, ta rút ra: Khi một phản ứng có hằng số tốc độ k lớn, thì nhiệt độ sẽ làm tốc độ phản ứng thay đổi mạnh hơn.
– Cái sai thứ nhất : Câu nói “k càng lớn thì phản ứng càng nhạy với nhiệt độ” là ngụy biện nhân quả, vì: K là kết quả của Ea và T không phải là nguyên nhân dẫn đến độ nhạy với T
– Nếu bỏ qua cái sai thứ nhất, thì vẫn còn một cái sai nữa: Ảnh hưởng của nhiệt độ đến phản ứng không phụ thuộc vào độ lớn của k, mà phụ thuộc vào độ lớn của năng lượng hoạt hóa Ea, giải thích
Ta có phương trình Arrhenius: k=A * e^ (-Ea/RT )
– Có 3 đại lượng cần quan tâm là :
+ Ea: năng lượng hoạt hóa
+ T: nhiệt độ ( độ K )
+ k: hằng số tốc độ phản ứng
– Nếu tăng T thì đúng là K sẽ tăng nhưng điều đó không đồng nghĩa với việc nhiệt độ sẽ ảnh hưởng mạnh hơn đến phản ứng ( rất nhiều người lầm tưởng ý nghĩa của 2 phát biểu: T tăng thì K tăng và T tăng thì sự ảnh hưởng của nhiệt độ đến K tăng )
– Để xét xem nhiệt độ nếu tăng hay giảm sẽ ảnh hưởng mạnh hay yếu đến phản ứng thì ta nên dựa vào Ea ( năng lượng hoạt hóa )
– Dưới đây là ví dụ để chứng minh rằng K lớn không đồng nghĩa với việc ảnh hưởng của nhiệt độ đến phản ứng là lớn
VD:
Phản ứng thứ nhất có năng lượng hoạt hóa thấp, chỉ khoảng 20 kJ/mol. Vì EaE_aEa thấp, nên dù nhiệt độ thay đổi, tốc độ phản ứng cũng không biến động nhiều. Giả sử ở 25°C, hằng số tốc độ của phản ứng này rất lớn — tức là phản ứng xảy ra nhanh.
Phản ứng thứ hai có năng lượng hoạt hóa cao, khoảng 80 kJ/mol. Do EaE_aEa lớn, nên phản ứng này ban đầu diễn ra chậm, tức là k nhỏ ở nhiệt độ thường. Nhưng nếu ta tăng nhiệt độ, tốc độ phản ứng này sẽ tăng vọt, vì biểu thức mũ trong công thức Arrhenius bị ảnh hưởng mạnh hơn.Nếu không hiểu hãy xem ví dụ dưới
Xét riêng e^ (-Ea/RT ):
+ TN1: chọn Ea=20, R là hằng số không đổi
+ TN2: chọn Ea = 80, R là hằng số không đổi
Với T=bằng 273 và 500
=> thay lần lượt T=273 và T=500 vào e^ (-Ea/RT ) thì ta thấy sự chênh lệch của 2 kết quả tính được khi thay 2 giá trị T vào ở thí nghiệm 2 lớn hơn thí nghiệm 1
=> Ea mới là yếu tố chính tác động đến sự ảnh hưởng của nhiệt độ với tốc độ phản ứng
NÓI THÊM: Đây là một phát biểu ‘nghe có vẻ đúng’ nhưng thực chất là ngụy khoa học, gây hiểu sai bản chất vấn đề.
=> K lớn không nói lên điều gì về độ biến thiên của k theo T. Kể cả khi k lớn, nếu Ea nhỏ thì k sẽ tăng rất ít theo T. Ngược lại, một phản ứng có k nhỏ nhưng Ea lớn sẽ nhạy gấp nhiều lần với nhiệt độ.

