Nguyên tố X thuộc chu kì 3, nhóm VA trong bảng tuần hoàn các nguyên tố hóa học. Đồng vị bền Y của X có số khối bằng 31.
a) Xác định nguyên tố X; số proton, số electron và số neutron của đồng vị Y.
b) Viết công thức cấu tạo và công thức Lewis của các phân tử: XH3, XCl5. Dự đoán dạng hình học phân tử của từng chất theo mô hình VSEPR và giải thích.
c) Vì sao NH3 tan trong nước tốt hơn XH3?
Câu trả lời tốt nhất
(a) Nguyên tố X thuộc chu kì 3, nhóm VA trong bảng tuần hoàn —> Cấu hình: 1s2 2s2 2p6 3s2 3p3 (X là P)
Y có 15 proton, 15 electron và 16 neutron trong mỗi nguyên tử.
(b)
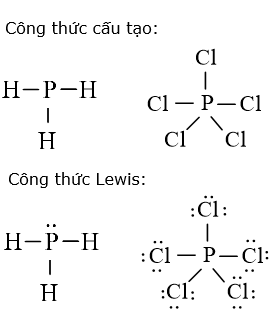
PH3 có dạng AX3E, dạng hình học phân tử là chóp tam giác.
PCl5 có dạng AX5, dạng hình học phân tử là lưỡng chóp tam giác.
(c) N có độ âm điện lớn hơn P nên liên kết N-H phân cực hơn liên kết P-H, NH3 có khả năng tạo liên kết hydrogen liên phân tử với H2O trong khi PH3 gần như không có khả năng này nên NH3 tan trong nước tốt hơn PH3.
